现有五种可溶性物质A、B、C、D、E,它们所含的阴、阳离子各不相同,分别含有五种阳离子(Na+、Al3+、Mg2+、Ba2+、Fe3+)和五种阴离子(Cl-、OH-、NO3-、CO32-、X)中的一种。
(1)某同学通过比较分析,认为无需检验就可判断其中必有的两种物质是______________和______________(均填化学式)。
(2)为了确定X,现将 (1) 中的两种物质记为A、B,当C与B的溶液混合时,产生红褐色沉淀和无色无味气体;当C与A的溶液混合时产生沉淀。向该沉淀中滴入过量稀HNO3,沉淀部分溶解,最后留有白色沉淀不再溶解。则:
①X为___________(填序号)。
A.SO32- B.SO42- C.CH3COO- D.SiO32-
②A中的化学键类型为______________。
③B的水溶液中所有离子的浓度由大到小的顺序为:_____________________________(用离子符号表示)。
④C与B混合时,对应的方程式为__________________________________ ___________。
___________。
(3)将Cu投入D溶液中,Cu不溶解;再滴加稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现。则物质D一定含有上述离子中的______________(填相应的离子符号)。
(4)利用上述已经确定的物质,再做一个实验就可以确定D、E,该实验可以是_________。
A.向D、E中分别加入足量的NaOH B.向D、E中分别加入AgNO3溶液
C.观察溶液的颜色 D.分别测D、E溶液导电能力
实验室配制500mL 0.2mol/L Na2SO4溶液,所需仪器有;若实验操作中某同学在加蒸馏水至刻度线时仰视观察确定蒸馏水的加入量,则所配溶液浓度(选填“ 偏高”“偏低”或“无影响”)。
偏高”“偏低”或“无影响”)。
下图中,已知B溶液能使酚酞试液变红,且焰色反应呈黄色;下图中气体E在气体G中燃烧产生苍白色火焰,D、F相遇会产生白烟。请按要求填空: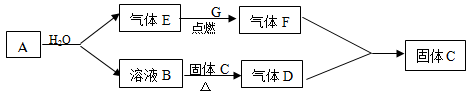
(1) A的名称是 ;F的化学式是。
;F的化学式是。
(2) B→D反应的化学方程式。
某无色混合气体可能含有Cl2、O2、HCl、NH3、NO、NO2中的两种或多种,将此混合气体经过浓硫酸后体积明显减少,将剩余气体排入空气中,很快变成红棕色。则原混合气体中:肯定含有,肯定不含有。
干燥的氨气可与等液体物质(至少选填两种)一起组装成功喷泉实验;向烧杯中的FeSO4溶液中滴加NaOH溶液,然后烧杯静置在空气中,可观察到的现象是;有关反应的化学方程式或离子方程式为:
①②;
向新制氯水中滴加AgNO溶液,现象是,相应的离子方程式为
①②;
化学科学在药物的开发、合成和使用中起着至关重要的作用。如小苏打、氢氧化铝、三硅酸镁等可治疗胃酸过多,硫酸亚铁可补铁、防治贫血。试回答下列问题:
(1)写出小苏打与胃酸作用的离子方程式: 。
。
(2)现有一瓶胃舒平药片(复方氢氧化铝 ),请设计实验验证其主要成分。(写出实验步骤和实验现象):将药片碾碎,,则说明其主要成分为氢氧化铝。
),请设计实验验证其主要成分。(写出实验步骤和实验现象):将药片碾碎,,则说明其主要成分为氢氧化铝。
(3)自选合适的氧化剂,将补铁剂中的Fe2+氧化成Fe3+,写出相关的离子反应方程式:
________________ ______。