体积为VL的密闭容器中通入a mol NO和b mol O2,反应后容器内氮原子和氧原子数之比为
| A.a/b | B.a/2b | C.a/(a+2b) | D.a/2(a+b) |
在恒温恒压下,向密闭容器中充入4molSO2和2molO2,发生如下反应:
2SO2(g)+O2(g) 2SO3(g)△H<0 。2min后,反应达到平衡,生成SO3为1.4mol,同时放出热量Q kJ,则下列分析正确的是
2SO3(g)△H<0 。2min后,反应达到平衡,生成SO3为1.4mol,同时放出热量Q kJ,则下列分析正确的是
| A.在该条件下,反应前后的压强之比为6 :5.3 |
| B.若反应开始时容器体积为2L,则v(SO3)=0.35mol/(L·min) |
| C.若把“恒温恒压下”改为“恒压绝热条件下”反应,平衡后n(SO3) < 1.4mol |
| D.若把“恒温恒压下”改为“恒温恒容下”反应,达平衡时放出热量大于Q kJ |
有关下列图象的说法正确的是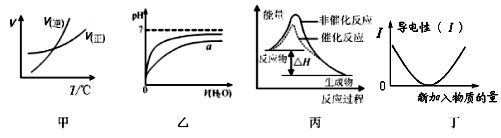
| A.由图甲表示的反应速率随温度变化的关系可知该反应的△H > 0 |
| B.若图乙表示向pH相同的盐酸与醋酸中分别加入水后溶液pH的变化,则其中曲线a对应的是醋酸 |
| C.图丙表示该反应为放热反应.且催化剂能降低反应的活化能、改变反应的焓变 |
| D.图丁可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化 |
下列说法正确的是
| A.若2H2(g)+O2(g) = 2H2O(g) ΔH=" -483.6" kJ·mol-1,则H2燃烧热为241.8 kJ·mol-1 |
| B.原子弹爆炸是放热反应 |
| C.若C(石墨,s) = C(金刚石,s) ΔH>0,则石墨能量低且键能小 |
| D.由BaSO4(s) + 4C(s) =" 4CO(g)" + BaS(s) △H1 = +571.2kJ•mol-1 ① |
BaSO4(s) + 2C(s) = 2CO2(g) + BaS(s) △H2 = +226.2kJ•mol-1②
可得反应C(s) + CO2(g) =" 2CO(g)" 的△H = +172.5kJ•mol-1
某溶液中可能含有H+、NH4+、Mg2+、Fe3+、Al3+、SO42-、HCO3-等离子。当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随加入NaOH溶液的体积变化如右图所示,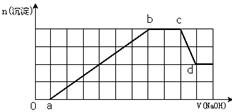
下列说法正确的是
| A.d点溶液中含有的溶质只有Na2SO4 |
| B.原溶液中含有的Fe3+和Al3+的物质的量之比为1:1 |
| C.ab段发生的离子反应为:Al3++3OH-= Al(OH)3↓, Mg2++2OH-= Mg(OH)2↓ |
| D.原溶液中含有的阳离子必定有H+、NH4+、Al3+, 且Mg2+和Fe3+至少存在一种 |
将CO2气体缓缓地通入到含KOH、Ba(OH)2和KAlO2的混合溶液中直至过量,生成沉淀的物质的量与所通CO2的体积关系如图所示。下列关于整个反应进程中的各种描述不正确的是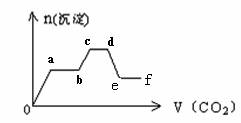
| A.o—a段反应的化学方程式是:Ba(OH)2+ CO2= BaCO3↓+ H2O |
| B.b—c段反应的离子方程式是:2AlO2-+ 3H2O+ CO2=2Al(OH)3↓+ CO32- |
| C.a—b段与c—d段所发生的反应相同 |
| D.d—e段沉淀的减少是由于碳酸钡固体的消失所致 |