氢氧燃料电池是将H2和O2分别通入电池,穿 过浸入20%—40%的KOH溶液的多孔碳电极,其电极反应式为:H2+2OH--2e-====2H2O和
过浸入20%—40%的KOH溶液的多孔碳电极,其电极反应式为:H2+2OH--2e-====2H2O和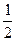 O2+H
O2+H 2O+2e-====2OH-则下列叙述正确的是 (
2O+2e-====2OH-则下列叙述正确的是 ( )
)
| A.通H2的极是正极,通入O2的极是负极 | B.通O2的极是正极,通入H2的极是负极 |
| C.工作一段时间后电解质溶液碱性增强 | D.工作时负极区附近碱性不变 |
NA表示阿伏加德罗常数,下列判断正确的是
| A.含NA个Na+的Na2O溶解于1L水中,Na+的物质的量浓度为1mol·L-1 |
| B.100mL Imol·L-1AlCl3溶液中含的阳离子数大于0.1NA |
| C.标准状况下,22.4L二氯甲烷的分子数为NA |
| D.含0.2mol H2SO4的浓硫酸与足量的铜反应,生成的SO2的分子数为0.1NA |
分类是化学学习和研究中的常用手段,下列分类依据和结论都正确的是
| A.浓HC1、浓H2SO4、浓HNO3均具有氧化性,都属氧化性酸 |
| B.Na2O、SO2、BaSO4在熔融状态或溶于水时均能导电,都属电解质 |
| C.NaOH、HNO3、NaNO3在水溶液中均能电离出离子,都属离子化合物 |
| D.金刚石、二氧化硅、碳化硅晶体中的原子均以共价键结合,都属原子晶体 |
下列化学用语正确的是
①Na+的结构示意图 ②乙酸的分子式:CH3COOH
②乙酸的分子式:CH3COOH
③HC1O的电子式: ④葡萄糖的实验式:CH2O
④葡萄糖的实验式:CH2O
⑤聚乙烯的结构简式: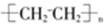 ⑥CO2的比例模型:
⑥CO2的比例模型:
| A.①②④ | B.②③⑥ | C.①④⑤ | D.③⑤⑥ |
以色列科学家发现准晶体独享2011年诺贝尔化学奖。已知的准晶体都是金属互化物。有关准晶体的组成与结构的规律仍在研究之中。人们发现组成为铝-铜-铁-铬的准晶体具有低摩擦系数、高硬度、低表面能以及低传热性,正被开发为炒菜锅的镀层;Al65Cu23Fe12十分耐磨,被开发为高温电弧喷嘴的镀层。下列说法正确的是
| A.离子化合物形成的晶体一定有金属元素 | B.合金是纯净物 |
| C.共价化合物中一定没有非极性键 | D.准晶体可开发成为新型材料 |
某含铬(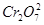 )废水用硫酸亚铁铵[
)废水用硫酸亚铁铵[ ]处理,反应中铁元素和铬元素
]处理,反应中铁元素和铬元素 完全转化为沉淀,该沉淀干燥后得到
完全转化为沉淀,该沉淀干燥后得到 ,不考虑处理过程中的实际损耗,下列叙述错误的是
,不考虑处理过程中的实际损耗,下列叙述错误的是
A.消耗硫酸亚铁铵的物质的量为 |
B.处理废水中的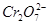 的物质的量为 的物质的量为 |
C.反应中发 生转移的电子数为 生转移的电子数为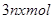 |
D.在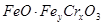 当中 当中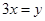 |