下列叙述正确的是
| A.使阴、阳离子结合成化合物的静电作用叫做离子键 |
| B.金属元素与非金属元素相化合时一定形成离子键 |
| C.在化学反应中,某元素由化合态变为游离态,该元素被还原 |
D.失电子难的原子获得电子的能力一 定强 定强 |
下列液体均处于25℃,有关叙述正确的是()
| A.某物质的溶液pH <7,则该物质一定是酸或强酸弱碱盐 |
B.Ag Cl在相同物质的量浓度的CaCl2和NaCl溶液中的溶解度相同 Cl在相同物质的量浓度的CaCl2和NaCl溶液中的溶解度相同 |
| C.pH=5.6的CH3COOH与CH3COONa混合溶液中,c(Na+)> c(CH3COO一) |
| D.pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍 |
若NA表示阿伏加德罗常数,下列说法正确的是()
| A.0.2 mol过氧化氢完全分解转移的电子数目为0.4 NA |
| B.12.8g Cu与足量HNO3反应生成NO和NO2,转移电子数目为0.2 NA’ |
| C.1 mol C3OH62分子中含有共价键的数目为91 NA |
| D.1 mol SiO2晶体中含有NASiO2个分子 |
化学已渗透到人类生活的各个方面。下列说法不正确的是()
| A.人造纤维、合成纤维和光导纤维都是有机高分子化合物 |
| B.可以用Si3N4、Al2O3制作高温结构陶瓷制品 |
| C.地球上CH4、CO2等气体含量上升容易导致温室效应加剧,进而引发灾难性气候 |
| D.禁止使用四乙基铅作汽油抗爆震剂,可减少汽车尾气污染 |
发展低碳经济、减少能源消耗、走可持续的发展之路,这对中国经济发展既是机遇也是挑战,下列说法不正确的是()
| A.积极开发风能发电和水力发电。 |
| B.尽量用纯液态有机物代替水作溶剂。 |
| C.提高原子利用率,发展绿色化学 |
| D.积极开发半导体节能灯具 |
物质X、Y、Z、W有如下图所示的转化关系,且△H=△H1+△H2,则X、Y可能是
①C和CO ②P和PCl3③AlCl 和Al(OH)3④NaOH和Na2CO3⑤Fe和FeCl
和Al(OH)3④NaOH和Na2CO3⑤Fe和FeCl 中的
中的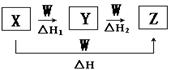
| A.①②③ | B.②③④ | C.③④⑤ | D.①②③④ |