X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示。若Y原子的最外层电子数是次外层电子数的3倍,则下列说法中正确的是
| A.离子半径:W>Z> Y >X |
| B.最高价氧化物对应的水化物的酸性:Z>W>X |
| C.4种元素的氢化物中,一定只含有极性共价键。 |
| D.4种元素的常见单质中,只有Z的单质常温下为固体 |
将51.2gCu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物
共0.9mol,这些气体恰好能被500ml 2mol/LNaOH溶液完全吸收,生成含NaNO3和NaNO2的
盐溶液,其中NaNO3的物质的量为()
| A.0.2mol | B.0.4mol | C.0.8mol | D.0.9mol |
无色溶液可能含有K+、Al3+、Mg2+、NH4+、Cl-、SO42-、HCO3-、MnO4-中的几种。为确定其成分,做如下实验:①取部分溶液,加入适量Na2O2固体,产生无色无味的气体和白色沉淀,再加入足量的NaOH溶液后白色沉淀部分溶解;②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,有白色沉淀产生。下列推断正确的是()
| A.肯定有Al3+、Mg2+、NH4+、Cl- | B.可能有K+、Cl-、MnO4- |
| C.肯定有Al3+、Mg2+、SO42- | D.肯定没有K+、HCO3-、MnO4- |
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示,下列说法正确的是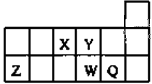
| A.元素X与元素Z的最高正化合价之和的数值等于8 |
| B.原子半径的大小顺序为:rX>rY>rZ>rW>rQ |
| C.离子Y2-和Z3+的核外电子数和电子层数都不相同 |
| D.元素W的最高价氧化物对应的水化物的酸性比Q的强 |
用图所示装置进行实验,下列对实验现象的解释不合理的是()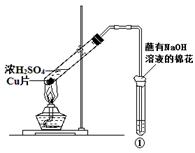
| ①中试剂 |
①中现象 |
解释 |
|
| A |
Ba(NO3)2溶液 |
生成白色沉淀 |
SO32-与Ba2+生成白色BaSO3沉淀 |
| B |
品红溶液 |
溶液褪色 |
SO2具有漂白性 |
| C |
紫色石蕊溶液 |
溶液变红 |
SO2与水反应生成酸 |
| D |
酸性KMnO4溶液 |
紫色褪去 |
SO2具有还原性 |
下列实验误差分析错误的是()
| A.用润湿的pH试纸测稀碱溶液的pH,测定值偏小 |
| B.用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小 |
| C.滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小 |
| D.测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度值偏小 |