已知1-18号元素的简单离子aA2+、b B+、cC-、dD3-都具有相同的电子层结构,下列关系正确的是
B+、cC-、dD3-都具有相同的电子层结构,下列关系正确的是
| A.原子序数:a-2= d |
| B.原子半径:B>A>C>D |
C.离子半径:dD3- > cC-> bB+ >aA2+ >aA2+ |
| D.单质的还原性:B>A>C>D |
已知镓(31Ga)和溴(35Br)是第四周期的主族元素。下列分析正确的是
| A.与镓同主族且相邻周期的元素,其原子序数为23或49 |
| B.与镓同周期且相邻主族的元素,其原子序数为30或32 |
| C.原子半径:Br>Ga> Cl> Al |
| D.碱性:KOH>Ga(OH)3>Al(OH)3 |
合成尿素的反应2NH3(g) + CO2(g)→CO(NH2)2(s)(尿素) + H2O(l) + Q分两步进行:
①2NH3(g) + CO2(g)→NH4COONH2(s) + Q1,
②NH4COONH2(s)→CO(NH2)2(s) + H2O(l)–Q2。
下列示意图中,能正确表示合成尿素过程中能量变化的是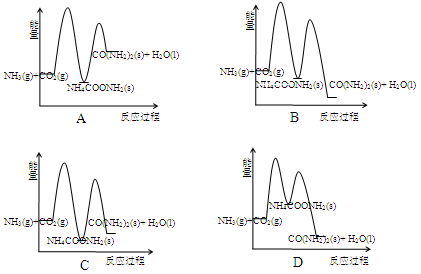
用图中所示的装置进行实验,实验现象与预测不一致的是
| ①中的物质 |
②中的物质 |
预测现象 |
|
| A |
浓氨水 |
FeCl3溶液 |
②中有红褐色沉淀 |
| B |
浓氨水 |
浓盐酸 |
③中有白烟 |
| C |
浓硝酸 |
淀粉KI溶液 |
②中溶液变为蓝色 |
| D |
饱和亚硫酸 |
蓝色石蕊试液 |
②中溶液先变红色又褪色 |
一种新的储氢方法,其原理是NaHCO3+ H2 HCOONa+ H2O。下列叙述正确的是
HCOONa+ H2O。下列叙述正确的是
| A.储氢、释氢的过程均无能量变化 |
| B.NaHCO3、HCOONa均含有离子键和共价键 |
| C.储氢过程中NaHCO3被氧化 |
| D.释氢过程中每消耗0.1molH2O放出2.24L的H2 |
元素的原子结构决定其性质和在周期表中的位置。下列叙述正确的是
| A.多电子原子中,在离核较近的区域内运动的电子能量较高 |
| B.原子核外电子的数目越多,电子的运动状态就越多 |
| C.轨道表示式,是对原子核外电子运动状态最完美的描述 |
| D.所有元素原子的最外层电子数都等于该元素的最高化合价 |