A、B、C、D、E分别为(NH4)2SO4、NH4Cl 、NaCl 、Na2SO4、Ba(OH)2五种溶液中的某一种,把它们两两混合:
(1)A和B混合产生白色沉淀,加热,无明显变化;
(2)B和C混合产生白色沉淀,加热,产生使湿润红色石蕊试纸变蓝的气体;
(3)B和E混合无明显变化,加热,产生使湿润红色石蕊试变蓝的气体。
根据以上现象,判断A、B、C、D、E各为什么物质。
A: 、B: 、C: 、D: 、E: 。
写出B和E混合加热的的化学方程式: 
快乐是什么?精神病学专家通过实验发现:在大脑的相应部位—-“奖赏中心”,给予柔和的电击,便会使大脑处于极度快乐的状态。人们已经将“奖赏中心”各部分的脑电图绘制出来,并认为,在各区域之间传递信息的化学物质是多巴胺,所以“奖赏中心”又称为多巴胺系统。多巴胺结构如下图: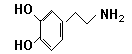
(1)试判断多巴胺能发生的化学反应。
| A.加成 | B.消去 | C.氧化 | D.水解 |
(2)写出与多巴胺互为同分异构体且属于1,3,5-三取代苯并且苯环上直接连有一个羟基和一个氨基且分别能与钠和氢氧化钠反应,消耗钠与氢氧化钠的物质的量之比为2:1的所有物质的结构简式:
。
(3)多巴胺可由香兰素与硝基甲烷缩合,再经锌-盐酸还原水解而得。合成过程表示如下: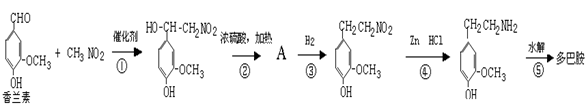
请写出②、⑤两步的化学方程式:
②:
⑤:
中和热是指酸跟碱发生中和反应生成lmol H2O所放出的热量。某学生想通过测定反应过程中所放出的热量来计算中和热。他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应。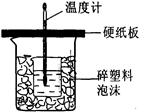
请回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是____________,烧杯间填满碎塑料泡沫的作用是_________________________。
(2)大烧杯上如不盖硬纸板,则求得的中和热数值_______(填“偏大”、“偏小’、“无影响”)
(3)实验中改用60 mL 0.50 mol/L的盐酸跟50mL 0.55 mol/L的NaOH溶 液进行反应,与上述实验相比,所求中和热的数值会________(填“相等”或“不相等”),理由是______________________。
(4)设50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液反应的反应热为△H1,25mL0.5mol/L的浓硫酸与50mL0.55mol/L的NaOH溶液反应的反应热为△H2, 50mL0.5mol/L的醋酸与50mL0.55mol/L的NaOH溶液反应的反应热为△H3,则△H1、△H2、△H3的关系是。(用“>”“<”或“=”连接)
已知: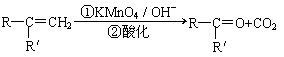 (R、R'可表示烃基或官能团)
(R、R'可表示烃基或官能团)
A可发生如下转化(方框内物质均为有机物,部分无机产物已略去):
请回答:
(1)F的蒸气密度是相同条件下H2密度的31倍,且分子中无甲基。已知1 mol F与足量金属钠作用产生H2 22.4 L(标准状况),则F的分子式是__ ______,名称是___ _____。
(2)G与F的相对分子质量之差为4,则G具有的性质是________(填字母)。
a.可与银氨溶液反应
b.可与乙酸发生酯化反应
c.可与氢气发生加成反应
d.1 mol G最多可与2 mol新制Cu(OH)2发生反应
(3)D能与NaHCO3溶液发生反应,且两分子D可以反应得到含有六元环的酯类化合物,E可使溴的四氯化碳溶液褪色,则D→E的化学方程式是_______________ _________,该反应类型是________反应。
(4)H与B互为同分异构体,且所含官能团与B相同,则H的结构简式可能是:_____________________、____________________。
(5)A转化为B和F的化学方程式是______________________。
PM2.5(可入肺颗粒物)污染跟冬季燃煤密切相关,燃煤还同时排放大量的CO2、SO2和NOx最近有科学家提出构想:把空气吹入饱和碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇。
①已知在常温常压下:
2CH3OH(l)+3O2(g) = 2CO2(g)+4H2O(g) ∆H = -1275.6 kJ/mol
2CO(g)+O2(g)=2CO2(g)∆H = -566.0 kJ/mol
H2O(g)=H2O(1) ∆H = -44.0 kJ/mol
则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为_____________________。
②以甲醇和氧气反应制成的燃料电池如图所示,该电池工作过程中O2应从______(填“c”或“b”)口通入,电池正极反应式为__________________。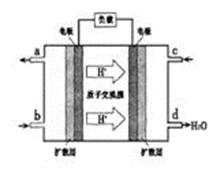
火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当把0.4mol液态肼和0.8mol液态 H2O2混合恰好完全反应,生成氮气和水蒸气,放出256 kJ的热量。
(1)反应的热化学方程式为。
(2)又已知16g液态肼与液态双氧水反应生成液态水时放出的热量是408 kJ。则H2O(g)=H2O(l)
的ΔH=。
(3)已知N2(g) + 2O2(g) ="=" 2NO2(g);△H=+67.7KJ/mol,
N2H4(g) + O2(g) ="=" N2(g)+2H2O(g);△H= —534KJ/mol,
则肼与NO2完全反应的热化学方程式为_____ _____________________。