20世纪80年代后,人们发现和证实了碳的另一类单质,它们是由一系列偶数个碳原子组成的分子,其中C60(足球烯,分子中含有30个双键)最具代表性。下图所示为n个C60连接而成的物质X。下列有关说法不正确的是
| A.X难溶于水 | B.X的摩尔质量为720n |
| C.X是碳的一种同素异形体 | D.一定条件下X可与H2发生加成反应 |
下列实验基本操作及注意事项中,主要出于安全考虑的是
| A.实验剩余的药品不能放回原试剂瓶 |
| B.酒精灯内酒精不能多于酒精灯容积的2/3 |
| C.实验结束后将试管清洗干净 |
| D.胶头滴管不能交叉使用 |
运输浓硫酸的车辆上贴有的危险化学品标志是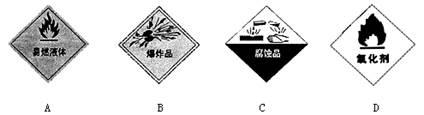
下列实验操作正确的是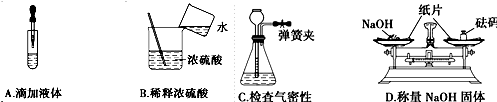
除去下列物质中的杂质(括号内为杂质),所选的试剂及操作方法均正确的一组是
| 选项 |
待提纯的物质 |
选用的试剂 |
操作的方法 |
| A |
CaCO3(NaCl) |
水 |
溶解、过滤、蒸发 |
| B |
Cu(CuO) |
稀盐酸 |
溶解、过滤、洗涤、干燥 |
| C |
CuSO4(H2SO4) |
氢氧化钠溶液 |
过滤 |
| D |
CO2(HCl) |
氢氧化钠溶液 |
洗气 |
下列溶液中,溶质的物质的量浓度为1 mol·L-1的是
| A.将80 g NaOH溶于2 L 水所得的溶液 |
| B.将0.5 mol·L-1的NaNO3溶液100 mL 加热蒸发掉50 g水所得的溶液 |
| C.将40 g NaOH 溶于水并配成1 L的溶液 |
| D.含K+为4 mol·L-1的K2SO4溶液 |