在2 L容积不变的容器中,发生N2+3H2 2NH3的反应。现通入4 mol H2和4 mol N2,10 s内用H2表示的反应速率为0.12 mol/(L·s),则10 s后容器中N2的物质的量是
2NH3的反应。现通入4 mol H2和4 mol N2,10 s内用H2表示的反应速率为0.12 mol/(L·s),则10 s后容器中N2的物质的量是
| A.1.6 mol | B.2.8 mol | C.3.2 mol | D.3.6 mol |
迷迭香酸具有抗氧化、延缓衰老、减肥降脂等功效,它的结构简式为: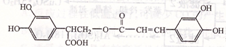 ,以邻苯二酚为原料合成迷迭香酸的路线为:
,以邻苯二酚为原料合成迷迭香酸的路线为: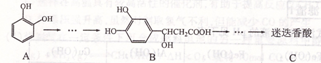
下列说法正确的是()
| A.有机物B中含有1个手性碳原子 |
| B.有机物A分子中所有原子一定在同一平面上 |
| C.有机物C在稀硫酸催化下水解的一种产物是B |
| D.1mol B与足量的NaOH溶液反应,最多可消耗3mol NaOH |
下列有关说法正确的是()
| A.反应:2CO(g) +2NO(g) |
B.0.1mol·L-1'Na2 CO3溶液加蒸馏水稀释,CO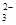 '的水解程度变大,溶液的pH不断增大 '的水解程度变大,溶液的pH不断增大 |
| C.电解精炼铜过程中,阳极质量的减少量与阴极质量的增加量一定相等 |
D.C(s) +CO2(g) 2CO(g)△H>0,其他条件不变时升高温度,反应速率v(CO2)和CO2的平衡转化率均增大 2CO(g)△H>0,其他条件不变时升高温度,反应速率v(CO2)和CO2的平衡转化率均增大 |
下列离子方程式中正确的是()
A.用石墨作电极电解饱和NaCl溶液:2C1-+2H2O Cl2↑+H2↑+2OH- Cl2↑+H2↑+2OH- |
B.向明矾溶液中逐滴加入Ba( OH)2溶液至Al3+刚好沉淀完全:Al3+ +SO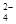 + Ba2+ +3OH- + Ba2+ +3OH- |
| C.过量氯气通人溴化亚铁溶液中2Cl2 +2Fe2+ +2Br- |
| D.向氯化铝溶液通入过量的氨气:Al3+ +4OH- |
设NA为阿伏加德罗常数的值,下列说法正确的是()
| A.1L0.1mol·L-1的氨水中含有的NH3分子数为0.1NA |
| B.标准状况下,2. 24L的CCl4中含有的C-Cl键数为0.4NA |
| C.常温常压下,3.0g葡萄糖和冰醋酸的混合物中含有的原子总数为0.4NA |
| D.标准状况下,Na2O2与足量CO2反应生成2.24L O2,转移电子数为0.4NA |
亚硝酸钠是一种工业用盐,广泛用于物质合成、金属表面处理等,它的一些性质或用途见图。下列说法不正确的是()
| A.NaNO2的稳定性大于NH4NO2 |
| B.NaNO2与N2 H4反应,NaNO2是氧化剂 |
| C.可用淀粉碘化钾试纸和食醋鉴别NaCl与NaNO2 |
| D.NaN3分解,每产生1molN2转移6mole- |