我国首创的以铝、空气、海水为能源的新型海水标志灯已研制成功。这种灯以海水为电解质,靠空气中的氧气使铝不断氧化而产生电能,其正极电极反应式为:
 ,负极电极反应式为:
,负极电极反应式为: ,只要将灯放入海水中,数分钟后就会发出耀眼的光,其能量比电池高20~50倍。
,只要将灯放入海水中,数分钟后就会发出耀眼的光,其能量比电池高20~50倍。
(1)此种新型电池的负极材料是
(2)电池总反应式为
硫-氨热化学循环制氢示意图如下: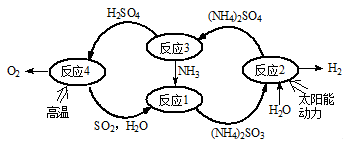
(1)反应1的离子方程式为 。
(2)反应2能量转化主要方式为 。
(3)反应3中控制反应条件很重要,不同条件下硫酸铵分解产物不同。若在400℃时分解,产物除水蒸气外还有A、B、C三种气体,A是空气中含量最多的单质,B能使湿润的红色石蕊试纸变蓝,C能使品红溶液褪色。则400℃时硫酸铵分解的化学方程式为 。
(4)反应4是由(a)、(b)两步反应组成:
H2SO4(l) =SO3(g) +H2O(g),△H=+177kJ•mol-1 …………(a)
2SO3(g) 2SO2(g) + O2(g),△H="+196" kJ•mol-1…………(b)
2SO2(g) + O2(g),△H="+196" kJ•mol-1…………(b)
①则H2SO4(l)分解为SO2(g)、O2(g)及H2O(g)的热化学方程式为: 。
②在恒温密闭容器中,控制不同温度进行SO3分解实验。以SO3起始浓度均为cmol·L-1,测定SO3的转化率,结果如右图,图中Ⅰ曲线为SO3的平衡转化率与温度的关系,Ⅱ曲线表示不同温度下反应经过相同反应时间且未达到化学平衡时SO3的转化率。
i)图中点X与点Z的平衡常数K:K(X) K(Z)(选填:>,<,=);
ii)Y点对应温度下的反应速率:v(正) v(逆)(选填:>,<,=);
iii)随温度的升高,Ⅱ曲线逼近Ⅰ曲线的原因是: 。
CMA(醋酸钙、醋酸镁固体的混合物)是高速公路的绿色融雪剂。以生物质废液——木醋液(主要成分乙酸,以及少量的甲醇、苯酚、焦油等杂质)及白云石(主要成分MgCO3·CaCO3,含SiO2等杂质)等为原料生产CMA的实验流程如下:
(1)步骤①发生的反应离子方程式为 。
(2)步骤②所得滤渣1的主要成分为 (写化学式);步骤②所得滤液常呈褐色,颜色除与木醋液中含有少量的有色的焦油有关外,产生颜色的另一主要原因是 。
(3)已知CMA中钙、镁的物质的量之比与出水率(与融雪效果成正比)关系如右图所示,步骤④的目的除调节n(Ca)∶n(Mg)约为 (选填: 1∶2;3∶7;2∶3)外,另一目的是 。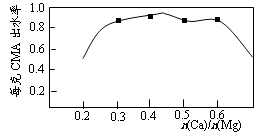
(4)步骤⑥包含的操作有 、过滤、洗涤及干燥。
已知A、B、C、D、E、F为元素周期表中原子序数依次增大的前20号元素,A与B;C、D与E分别位于同一周期。A原子L层上有2对成对电子, B、C、D的核外电子排布相同的简单离子可形成一种C3DB6型离子晶体X,,CE、FA为电子数相同的离子晶体。
(1)写出A元素的基态原子价电子排布式 ;F离子电子排布式 。
(2)写出X的化学式 和化学名称 。
(3)写出X涉及化工生产中的一个化学方程式 。
(4)试解释工业冶炼D不以DE3而是以D2A3为原料的原因: 。
(5)CE、FA的晶格能分别为786 KJ/mol l、3401KJ/mo,试分析导致两者晶格能差异的主要原因是: 。
(6)F与B可形成离子化合物,其晶胞结构如图所示: F与B形成离子化合物的化学式为____________;该离子化合物晶体的密度为a g/cm3,则晶胞的体积是(只要求列出算式)。
开发新能源,使用清洁燃料,可以达到减少污染的目的。
(1)由C、H、O三种元素中的两种和三种分别组成的燃料物质甲和乙,其分子中均有氧,且1个乙分子中含有18个电子,则甲和乙分别是 。乙是一种清洁燃料,工业上可用甲和氢气反应制得。
① T1温度时,在体积为2 L的密闭容器中充入2 mol甲和6 mol H2,反应达到平衡后,测得c(甲)=0.2 mol/L,则乙在平衡混合物中的物质的量分数是 。(保留两位有效数字)
② 升高温度到T2时,反应的平衡常数为1,下列措施可以提高甲的转化率的是________(填字母)。
A.加入2 mol甲 B.充入氮气 C.分离出乙 D.升高温度
(2)甲烷也是一种清洁燃料,但不完全燃烧时热效率降低并会产生有毒气体造成污染。已知:
CH4(g) + 2O2(g) = CO2(g) + 2H2O(l) ΔH1=―890.3 kJ/mol
2CO (g) + O2(g) = 2CO2(g) ΔH2=―566.0 kJ/mol
则甲烷不完全燃烧生成一氧化碳和液态水时的热效率是完全燃烧时的________倍(计算结果保留1位小数)。
(3)甲烷燃料电池可以提升能量利用率。右图是利用甲烷燃料电池电解50 mL 2 mol/L的氯化铜溶液的装置示意图(O2-可以在固态电解质中自由移动)。请回答: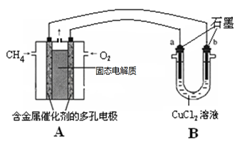
① 甲烷燃料电池的负极反应式是 。
② 当线路中有0.1 mol电子通过时,______________(填“a”或“b”)极增重____________g。
合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g)+3H2(g)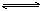 2NH3(g),500 K、30 MPa下n(NH3)、n(H2)和n(N2)随时间变化的关系如图所示。
2NH3(g),500 K、30 MPa下n(NH3)、n(H2)和n(N2)随时间变化的关系如图所示。
请回答下列问题: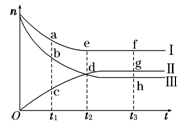
(1)上图中属于氢气物质的量随时间变化的曲线是 (填“Ⅰ”、“Ⅱ”或“Ⅲ”)。
(2)关于t2时刻的说法正确的是____________。
A.t2时该反应达到平衡状态
B.t2时Ⅱ和Ⅲ代表的物质反应速率相同
C.t2时氢气、氮气与氨气的反应速率之比为3∶1∶2
D.t2时氨气与氢气的物质的量相同
(3)对于Ⅱ所代表的物质,其逆反应速率最大的点是___________(填“c”、“d”或“g”);对于Ⅰ所代表的物质,其正反应速率最小的点是_____________(填“a”、“e”或“f”)。
(4)其他条件不变,只改变温度,在改变的这个温度下反应至t3时刻,此时n(H2)比图象中的值大,那么该温度可能是 。
A.673 K B.273 K C.373 K
(5)在密闭容器中充入2 mol N2和6 mol H2,一定条件下建立平衡:N2(g)+3H2(g) 2NH3(g) ΔH=-92.2 kJ/mol,测得N2的转化率为90%,则在此条件下,反应放出的热量为 kJ。若与上述反应的温度和体积相同时,向密闭容器中充入4 mol NH3,则达平衡后,反应 (填“放出”或“吸收”)的热量为 kJ。
2NH3(g) ΔH=-92.2 kJ/mol,测得N2的转化率为90%,则在此条件下,反应放出的热量为 kJ。若与上述反应的温度和体积相同时,向密闭容器中充入4 mol NH3,则达平衡后,反应 (填“放出”或“吸收”)的热量为 kJ。