向盛有1 mL 0.1 mol/L MgCl2溶液的试管中滴加1 mL 0.2 mol/L氨水,观察到有白色沉淀生成,再滴加1 mL 0.1 mol/L FeCl3溶液,发现白色沉淀转化为红褐色沉淀。由以上现象可以推知,下列叙述正确的是
| A.生成白色沉淀的离子方程式是:Mg2++2OH-="=" Mg(OH)2↓ |
| B.白色沉淀转化为红褐色沉淀的离子方程式是:3Mg(OH)2+2Fe3+==3Mg2++2Fe(OH)3 |
| C.上述实验说明Mg(OH)2的Ksp小于Fe(OH)3的Ksp |
| D.最后所得的溶液中离子浓度大小关系为: |
c(Cl-)>c(NH4+)>c(Mg2+)>c(Fe3+)>c(OH-)>c(H+)
常温下,下列各组离子在指定溶液中可能大量共存的是
| A.澄清透明的溶液中:Cu2+、Fe3+、NO3—、Cl— |
| B.使pH试纸变深蓝色的溶液中:NH4+、Na+、SO42—、Cl— |
| C.含有大量ClO—的溶液中:K+、Na+、I—、SO32— |
| D.c(Al3+) = 0.1 mol·L—1的溶液中:Na+、NH4+、AlO2—、SO42— |
某有机物A在酸性溶液中加热可发生如下反应: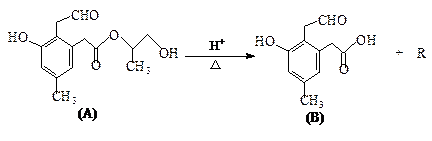
请回答下列问题:
(1)下列关于该有机物A说法错误的是。
①可发生银镜反应 ②1molA在一定条件下与氢气反应,最多可消耗5molH2
③能发生消去反应 ④1molA与烧碱溶液反应,最多可消耗4mol NaOH
(2)有机物B的化学式(分子式)为;B在铂的催化下,与足量氢气发生加成反应生成X,则X的结构简式为。
(3)有机物R的结构简式为; R与足量的醋酸发生反应(填基本反应类型)的化学方程式为:。
利用下列可逆反应可以将粗镍转化为纯度99.9%的高纯镍: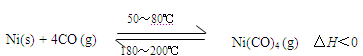
下列说法正确的是
| A.50~80℃时,适当增大压强,有利于Ni(CO)4的生成 |
| B.180~200℃时,气态的Ni(CO)4 会分解出纯Ni |
| C.提纯过程中,CO(g)的量不断减少 |
| D.温度越高,Ni(CO)4 (g)的转化率越低 |
下列离子方程式书写正确的是
| A.用稀硝酸洗涤做过银镜反应的试管:Ag + 4H+ + NO3¯ = Ag+ + NO↑ + 2H2O |
B.铝片跟氢氧化钠溶液反应:Al+2OH¯=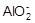 +H2↑ +H2↑ |
| C.碳酸钙溶于醋酸:CaCO3 + 2H+ = Ca2+ + CO2↑ + H2O |
D.苯酚钠溶液中通入少量CO2: -O¯+CO2+H2O = -O¯+CO2+H2O =  -OH +HCO3¯ -OH +HCO3¯ |
NA表示阿伏加德罗常数的值,下列叙述正确的是
| A.在1 L 0.2 mol·L-1的Na2CO3溶液中含有CO32—的数目为0.2NA |
| B.0.1 mol Fe参加氧化还原反应,转移的电子数目一定是0.3NA |
| C.标准状况下22.4 L CH4和C2H4的混合气体所含氢原子数为4NA |
| D.理论上氢氧燃料电池正极消耗11.2 L标准状况下气体时,外线路通过电子数为NA |