下列热化学方程式中△H的绝对值表示可燃物燃烧热的是
A.CO(g)+ 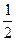 O2(g) ===CO2(g O2(g) ===CO2(g )△H=-283.0 kJ·mol-1 )△H=-283.0 kJ·mol-1 |
| B.CH4(g)+ 2O2(g) ===CO2(g)+2H2O(g)△H=-802.3 kJ·mol-1 |
| C.2H2(g)+ O2(g) ===2H2O(l)△H=-571.6kJ·mol-1 |
D.C(s)+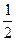 O2(g) ===CO(g)△H=-110.5kJ·mol-1 O2(g) ===CO(g)△H=-110.5kJ·mol-1 |
在用锌片、铜片和稀硫酸组成的原电池装置中,经过一段时间后,下列说法正确的是()
| A.铜片上有气泡产生,发生还原反应 |
| B.锌是负极,发生还原反应 |
| C.电流方向是从锌片沿导线流向铜片 |
| D.铜片逐渐溶解,被氧化 |
下列问题的解决中,与化学有关的是()
①治理污染②研究生命活动③防火防灾④消毒杀菌⑤制造新物质
| A.只有①② | B.只有①④⑤ | C.只有③④ | D.全部 |
下列物质在通常条件下能与氢氧化钠溶液反应的是()
| A.甲烷 | B.乙醇 | C.苯 | D.乙酸 |
下列离子方程式中,书写正确的是( )
| A.醋酸与烧碱混合:H++OH- ="==" H2O |
| B.大理石中加入盐酸:CO32- + 2H+ ="==" CO2↑ + H2O |
| C.稀硫酸滴在铁片上:Fe + 2H+ ="==" Fe2+ + H2↑ |
| D.硫酸铜溶液和氢氧化钡溶液混合:Cu2+ + 2OH- ="==" Cu(OH)2↓ |
实现下列转化通常需要加氧化剂才能实现的是()
| A.NaCl→HCl | B.NaCl→Cl2 | C.NaClO3→Cl2 | D.Cl2→HCl |