某温度时,AgCl在水中的沉淀溶解平衡曲线如图所示(提示:Ag Cl(s)
Cl(s) Ag+(aq)+Cl-(aq),其平衡常数Ksp=c(Ag+)·c(Cl-),称为溶度积常数;又知:
Ag+(aq)+Cl-(aq),其平衡常数Ksp=c(Ag+)·c(Cl-),称为溶度积常数;又知:
Ksp(AgCl)=1.8×10-10,Ksp(Ag2S)=6.3×10-50)。下列说法正确的是: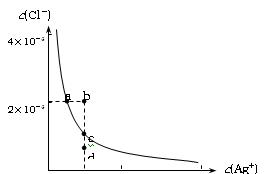
| A.加入NaCl可以使溶液由a点变到b点 |
| B.b点和d点均无AgCl沉淀生成 |
| C.a点对应的Ksp大于c点对应的Ksp |
D.向0.1mol/L的硝酸银溶液中滴加0.1mol/L的NaCl溶液至不再有白色沉淀生成,再向其中滴加0.1mol/L的Na2S溶液,白色沉淀转化为黑色沉淀。其沉淀转化的反应方程式为:2AgCl(s)+S2-(aq) Ag2S(s)+2Cl-(aq) 。 Ag2S(s)+2Cl-(aq) 。 |
如果发现了原子序数为116的元素,下列对它的叙述中正确的是()
①位于第7周期②非金属元素③最外电子层有6个电子④没有放射性
⑤属于氧族元素⑥属于锕系元素
| A.①③⑤ | B.②④⑥ | C.①②③ | D.③④⑤ |
在恒容密闭容器中,可逆反应H2(g)+ I2(g)  2HI(g)达到平衡时的标志是( )
2HI(g)达到平衡时的标志是( )
| A.1个I—I键断裂的同时,有2个H—I键断裂 | B.H2、I2、HI的浓度相等 |
| C.混合气体的质量不再改变 | D.混合气体密度恒定不变 |
下列化学用语正确的是
A.氧原子的结构示意图: |
B.CCl4的电子式:  |
C.CH4分子的比例模型: |
D.水分子的结构式:H—O—H |
设NA表示阿伏加德罗常数,下列叙述正确的是( )
| A.1.7g OH― 所含电子数为0.9NA | B.标准状况下,11.2 L HCl 所含质子数为18NA |
| C.常温下,11.2 L Cl2所含原子数为NA | D.0.5 mol D2O 中所含质子数为5NA |
几种短周期元素的原子半径及主要化合价如下表,下列叙述不正确的是( )
| 元素代号 |
X |
Y |
Z |
W |
V |
| 原子半径/nm |
0.090 |
0.118 |
0.075 |
0.073 |
0.102 |
| 主要化合价 |
+2 |
+3 |
+5、+3、-3 |
-2 |
+6、-2 |
A.X、Z、W位于同周期,Y与V位于同周期
B.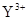 与
与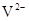 的核外电子数相等
的核外电子数相等
C.Y与W形成的化合物具有两性
D.Z的氢化物可与V的最高价氧化物的水溶液反应生成盐