下表为元素周期表的一部分,请回答有关问题:
| |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0A |
| 2 |
|
|
|
|
① |
|
② |
|
| 3 |
|
③ |
④ |
⑤ |
|
⑥ |
⑦] |
⑧ |
| 4 |
⑨ |
|
|
|
|
|
⑩ |
|
(1)⑤和⑧的元素符号是__▲__和__▲__ ;
(2)表中最活泼的金属是__▲_ ,非金属性最强的元素是_▲__(填写元素符号);
(3)表中能形成两性氢氧化物的元素是__▲_ ,分别写出该元素的氢氧化物与⑥最高价氧化物对应水化物反应的化学方程式: ___________▲____________ ,
(4)请设计一个实验方案,比较⑦、⑩单质氧化性的强弱:_______ __▲_________ 。
__▲_________ 。
(5)0.1 mol的单质⑦与50 mL 1.5 mol/L的FeBr2溶液反应,则被氧化的Fe2+和Br-的物质的量之比是: __▲__。
已知难溶于水的盐在水中存在溶解平衡:
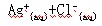
在一定温度下,水溶液中Ag+的物质的量浓度和Cl-的物质的量浓度的乘积为一常数,可用 KSP表示:KSP=c(Ag+) c(Cl-)=1.8·10-10
若把足量AgCl分别放入① 100 mL蒸馏水,② 100 mL 0.1 mol / L NaCl溶液,③ 100 mL 0.1 mol / L AlCl3溶液,④ 100 mL 0.1  mol / L MgCl2溶液中,搅拌后,在相同温度下Ag+浓度由大到小的顺序(用序号回答)是 ______ > ______ > ______ > ______。
mol / L MgCl2溶液中,搅拌后,在相同温度下Ag+浓度由大到小的顺序(用序号回答)是 ______ > ______ > ______ > ______。
(10分)常温下,有0.1mol/L的盐酸和0.1mol/L的醋酸溶液,回答下列问题:
①比较两溶液的pH ,盐酸____(填“<” 、“="”" 或 “>”)醋酸,写出醋酸电离的方程式______________________________。
②两种酸均能与氢氧化钠反应生成盐,其中醋酸与氢氧化钠反应能生成醋酸钠,实验室现有部分醋酸钠固体,取少量溶于水,溶液呈_______(填“酸性” 、“中性” 或 “碱性”),其原因是(用离子方程式表示)__________________________。
③向醋酸溶液中加入一定量的NaOH溶液,当测得溶液的pH=7时 ,溶液中离子的浓度大小为(填字母,下同),当测得溶液的pH<7时,溶液中离子的浓度大小为
,溶液中离子的浓度大小为(填字母,下同),当测得溶液的pH<7时,溶液中离子的浓度大小为
a.c(Na+)>c(CH3COO—)>c(OH—)>c(H+) b.c(Na+) = c(CH3COO—)>c(OH—) =c(H+)
c.c(CH3COO—)>c(Na+)>c(H+)>c(OH—) d.c(Na+)>c(CH3COO—)>c(H+)>c(OH—)
把1120 mL(标准状况时的体积)氯化氢溶解于水,配制成500 mL溶液,该溶液的氢离子浓度为mol / L,溶液的pH值为。
在Cl-、NH4+、HSO4-、Na+、HCO3-五种离子中,既不能电离又不能水解的离子是_______________,只能水解不能电离的离子是_____________,只能电离不能水解的离子是______________,既能电离又能水解的离子是_____________。
.有机物A  是合
是合 成高分子化合物HPMA的中间体,HPMA可用于锅炉阻垢剂。
成高分子化合物HPMA的中间体,HPMA可用于锅炉阻垢剂。
(1)有机物A能够发生的反应有:(填写字母)
a.取代反应 b.加成反应 c.消去反应 d.氧化反应
(2)有机物A在Cu做催化剂和加热条件下,与足量氧气充分反应生成有机物B。写出A→B的化学方程式。
(3)有机物B经氧化后生成有机物C,C可有如下图所示的转化关系: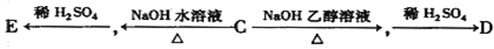
写出E的结构简式:;
(4)D在高温、高压和催化剂作用下反应生成HPMA,写出反应的化学方程式:
(5)F是E的一种同分异构体。0.1mol F与足量金属Na反应放出3.36L H2(标准状况下);0.1mol E与足量NaHCO3反应放出2.24LCO2(标准状况下);则F中含有的官能团的名称是,F能发生银镜反应。F的结构简式可能是:_、。