双氧水(H2O2)和水都是极弱的电解质。
(1)若把H2O2看成是二元弱酸,请写出它在水中的电离方程式 。
(2)鉴于H2O2显弱酸性,它能同强碱作用形成正盐,在一定条件下也可形成酸式盐,请写出H2O2与Ba(OH)2作用形成正盐的化学方程式: 。
(3)水电离生成H3O+和OH-叫做水的自偶电离。双氧水同水一样,也有极微弱的自偶电离,其自偶电离的方程式为 。
(4)除了过氧化氢跟碱的反应外,请你再写出一个可表明双氧水是弱酸的反应的化学方程式 。
某元素同位素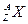 ,其氯化物XCl2 1.11g溶于水制成溶液后,加入1mol/L的AgNO3溶液20mL恰好完全反应。若这种同位素原子核内有20个中子,则:
,其氯化物XCl2 1.11g溶于水制成溶液后,加入1mol/L的AgNO3溶液20mL恰好完全反应。若这种同位素原子核内有20个中子,则:
(1)Z值和A值;Z=;A=;
(2)X元素在周期表中的位置;
(3)根据已学知识推测,把X的单质放入水中反应的化学方程式为.。
A、B、C、D、E五种短周期元素,它们的原子序数依次增大。B元素原子L层上的电子数为K层电子数的2倍;元素D的2价阴离子的核外电子排布与氖原子相同;E与A同主族;A和E 这两种元素与D都能形成X2Y、X2Y2型化合物。请回答:
(1)写出元素的符号:A;C_______
(2)画出D的离子结构示意图_____________,B在周期表的位置为。
(3)B的X2Y2型化合物结构式是_______,E的X2Y型化合物电子式为。
(4)B与D形成最高价化合物的电子式。
(5)C的氢化物和C的最高价氧化物的水化物反应生成M,M的化学式为,M中的化学键类型有__________________。
现有部分短周期元素的性质或原子结构如下表:
| 元素编号 |
元素性质或原子结构 |
| T |
M层上有6个电子 |
| X |
最外层电子数是次外层电子数的2倍 |
| Y |
常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z |
元素最高正价是+7价 |
(1)元素T为元素(填元素名称)。元素X的一种同位素可测定文物年代,这种同位素的符号是。
(2)元素Y与氢元素形成一种离子YH4+,写出该微粒的电子式
(用元素符号表示)。
(3)元素Z与元素T相比,非金属性较强的是(用元素符号表示),下列表述中能证明这一事实的是
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一。T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是,理由是
(8分)氮元素在生命活动中扮演着十分重要的角色,回答下列与氮及其化合物有关的问题
(1)为了提高农作物的产量,德国化学家哈伯、波施等科学家成功地开发了将氮气转化为氨气的生产工艺。请用化学方程式写出表示工业合成氨的反应原理;
(2)将氨气通入水中可制得氨水,氨水能使无色的酚酞变红。请用电离方程式表示其原因:;
(3)氨气可以跟多种物质发生反应,请将右图实验中有关反应的化学方程式填在横线上(铂作催化剂):、。
利用氧化还原反应原理配平以下化学方程式,并:
FeSO4 + KNO3 + H2SO4 === K2SO4 + Fe2(SO4)3 + NO↑+ H2O
(1)标出电子转移的方向和数目
(2)当电子转移了0.3mol时,有g氧化剂参加反应