向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液。下列对此现象说法正确的是
| A.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变 |
| B.沉淀溶解后,将生成深蓝色的配合离子[Cu(NH3)4] 2+ |
| C.向反应后的溶液中加入乙醇,溶液没有发生变化 |
| D.在[Cu(NH3)4] 2+离子中,Cu2+给出孤对电子,NH3提供空轨道 |
下列有关元素化合物的说法正确的是()
| A.将饱和的FeCl3溶液加热至沸腾,出现红褐色液体时,停止加热,制得Fe(OH)3胶体。 |
| B.将SO2通入BaCl2溶液,有白色沉淀生成,再加入硝酸,白色沉淀仍不消失 |
| C.实验室检验氨气的方法是将湿润的蓝色石蕊试纸靠近瓶口或管口,观察试纸是否呈红色 |
| D.在含Fe2O3、FeO、SiO2、Al2O3的矿石中,制备Fe2O3方法:可先用稀盐酸浸取炉渣,过滤;再将滤液先氧化,再加入过量NaOH溶液,再过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。 |
下列说法中,不正确的是()
| A.石油、天然气、可燃冰、植物油都属于化石燃料 |
| B.丙烯既能使溴的四氯化碳溶液褪色,又能在光照下与溴发生取代反应 |
| C.将饱和Na2CO3溶液加入混有少量乙酸的乙酸乙酯中,然后分液可除去乙酸乙酯中的少量乙酸 |
| D.利用葡萄糖能跟新制Cu(OH)2悬浊液反应生成红色物质,检验病人是否患“糖尿病” |
在25°C下,将,amol·L-1的醋酸(HAc)与0.01mol·L-1的氢氧化钠溶液等体积混合,反应平衡时溶液中c(Na+)=c(Ac-)。则下列说法中,不正确的是()
| A.此时醋酸和氢氧化钠溶液恰好中和 |
| B.反应后混合液的导电性一定弱于0.01mol·L-1的氢氧化钠溶液 |
| C.溶液中的离子浓度大小的顺序为c(Na+)=c(Ac-)>c(OH-)= c(H+) |
| D.a肯定大于0.01 |
已知某化学反应的平衡常数表达式为K=
 ,在不同的温度下该反应的平衡常数值分别为:
,在不同的温度下该反应的平衡常数值分别为:
| t℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
1.67 |
1.11 |
1.00 |
0.60 |
0.38 |
下列有关叙述不正确的是()
A.该反应的化学方程式是:CO(g)+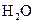 (g) (g) 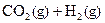 |
| B.上述反应的正反应是放热反应. |
C.如果在一定体积的密闭容器中加入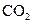 和 和 各1 mol,5 min后温度升高到 各1 mol,5 min后温度升高到830℃,此时测得 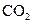 为0.4 mol时,该反应为平衡状态。 为0.4 mol时,该反应为平衡状态。 |
D.某温度下,如果平衡浓度符合下列关系式: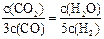 ,判断此时的温度是1000℃. ,判断此时的温度是1000℃. |
下列说法正确的是()
| A.在水电离出的c(H+)与c(OH-)乘积为10-28的溶液中能大量共存是:K+、Na+、HCO-3、Ca2+ |
| B.乙烯和环丙烷(C3H6)组成的28g混合气体中含有4×6.02×1023 个氢原子 |
| C.将铂丝用盐酸洗净后,在酒精灯的外焰上灼烧至没颜色,蘸取碳酸钾固体,再在酒精灯外焰灼烧,进行钾的焰色反应 |
| D.0.1mol·L-1CH3COOH溶液中,加水冲稀,电离平衡向电离方向移动,电离平衡常数增大 |