在元素周期表的短周期主族元素中,甲元素与乙、丙、丁三元素紧密相邻。甲、乙的原子序数之和等于丙的原子序数。这四种元素原子的最外层电子数之和为20。下列判断正确的是
| A.甲和乙所形成的化合物都是大气污染物 |
| B.原子半径:丙>乙>甲>丁 |
| C.气态氢化物的熔点:甲<丙 |
| D.最高价氧化物的对应水化物的酸性:丁>甲 |
下列溶液一定呈中性的是
| A.pH=7的溶液 |
| B.c(H)+=10-7 mol·L-1的溶液 |
| C.c(H+)/c(OH-)=10-14的溶液 |
| D.氨水和氯化铵的混合液中c(NH4+)=c(Cl-) |
已知某温度下某些弱酸的电离常数如下表:
| 弱酸 |
HCN |
HF |
CH3COOH |
HNO2 |
| Ka |
6.2×10-10 |
6.8×10-4 |
1.8×10-5 |
6.4×10-6 |
物质的量浓度都为0.1 mol·L-1的下列溶液中,pH最小的是
A.HCN B.HF C.CH3COOHD.HNO2
已知分解1mol H2O2放出热量98KJ。在含有少量I 的溶液中,H2O2分解的机理为:
的溶液中,H2O2分解的机理为:
① H2O2+ I
 H2O+IO
H2O+IO (慢)
(慢)
②H2O2+ IO
 H2O+O2+ I
H2O+O2+ I (快)
(快)
下列有关该反应的说法正确的是
A.反应速率与I 浓度有关 浓度有关 |
B.IO 也是该反应的催化剂 也是该反应的催化剂 |
| C.该化学反应速率由反应②决定 |
D. |
X、Y、Z均为短周期元素,X、Y处于同一周期,X、Z的最低价离子分别为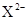 和
和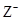 ,Y+和
,Y+和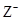 具有相同的电子层结构。下列说法正确的是
具有相同的电子层结构。下列说法正确的是
| A.原子的最外层电子数:X>Y>Z | B.单质沸点:X>Y>Z |
C.离子半径: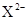 > Y+> > Y+>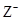 |
D.原子序数:X>Y>Z |
反应:2SO2+O2 2SO3,经过一段时间后, SO3的浓度增加了0.4mol/L,在这段时间内用O2表示的反应速率为0.04mol/(L·S),则这段时间为
2SO3,经过一段时间后, SO3的浓度增加了0.4mol/L,在这段时间内用O2表示的反应速率为0.04mol/(L·S),则这段时间为
| A.0.1S | B.2.5S | C.5S | D.10S |