丁烷催化裂解生成烷烃和烯烃,可按下列两种方式进行:
C4H10→C2H4+C2H6;C4H10→C H4+C3H6
某化学兴趣小组为了测定丁烷裂解气中CH 和C
和C H
H 的比例关系,设计实验如下图所示:
的比例关系,设计实验如下图所示:
如图连接好装置后,需进行的操作有:①给 D、G装置加热;②检查整套装置的气密性;③排出装置中的空气等……
D、G装置加热;②检查整套装置的气密性;③排出装置中的空气等……
注:CuO能将烃氧化成CO 和H
和H O;A
O;A l
l O
O 是烷烃裂解的催化剂;G后面装置已省略。
是烷烃裂解的催化剂;G后面装置已省略。
(1)这三步操作的先后顺序是_________(填序号)
(2)简要叙述证明空气已排尽的操作方法______________________。
(3)假定丁烷完全裂解,且流经各装置中的气体能完全反应。当装置E和F的总质量比反应前增加了0.7g,G装置中固体质量比反应前减少了1.76g,则在丁烷的裂解产物中
CH 和C
和C H
H

 的物质的量之比n(CH
的物质的量之比n(CH ):n(C
):n(C H
H )=______________。
)=______________。
(4)若对实验后E装置中的混合物再按以下流程进行实验:

①分离操作I、Ⅱ的名称分别是:I、_____________,Ⅱ、____________。
②Na SO
SO 溶液的作用是______________________。
溶液的作用是______________________。
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯。回答下列问题: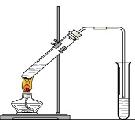
⑴写出制取乙酸乙酯的化学反应方程式
⑵浓硫酸的作用是:①;②
⑶饱和碳酸钠溶液的主要作用是
⑷装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,
目的是防止 。
⑸若要把制得的乙酸乙酯分离出来,应采用的实验操作是 。
为定性探究乙醇的性质,某化学课外小组通过查阅资料并设计了实验方案进行探究。
方案Ⅰ:在盛有少量无水乙醇的试管中,加入一粒除去煤油的金属钠,在试管口迅速塞上配有尖嘴导管的单孔塞,点燃放出的气体,并把一干燥的小烧杯罩在火焰上,在烧杯壁上出现液滴后,迅速倒转烧杯,向烧杯中加入少量的澄清石灰水,观察有无混浊产生。
(1)请写出乙醇与钠反应的化学方程式: ▲。
(2)以上实验设计因缺少必要的步骤而存在安全隐患,请你指出所缺少必要的步骤是
▲。
(3)若向烧杯中加入少量澄清石灰水后发现有混浊,则燃烧产生CO2的物质最可能是
▲ (写名称)。
方案Ⅱ:(1)取一根铜丝,把其中一端绕成螺旋状(增大接触面积)。点燃一盏酒精灯,把绕成螺旋状一端的铜丝移到酒精灯外焰上灼烧(如右图1),观察到的实验现象: ▲。
(2)把螺旋状铜丝往酒精灯内焰移动,观察到的实验现象: ▲,用化学方程式表示该现象产生的原理: ▲。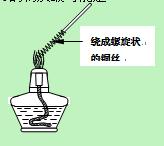
镁能在二氧化碳中燃烧:2Mg+CO22MgO+C,钠比镁更活泼,那么钠能在二氧化碳中燃烧吗?某研究性学习小组设计了如下装置进行探究。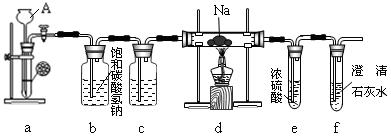
请回答下列问题:
(1)装置a的作用是,仪器A的名称。
(2)装置b的作用是,装置c中应盛放。
(3)实验过程中,在点燃d装置中的酒精灯前,必须经过必要的操作方可进行后续的实验,该必要的操作是。
(4)实验发现钠在充满二氧化碳气体的玻璃管里剧烈地燃烧,产生大量的白烟并伴有黑色物质生成。取一部分生成物于试管中,往试管中加水,白色物质溶解于水,黑色物质不溶。过滤,得到澄清的滤液。将滤纸上的黑色物质移入小试管中,加少量浓硫酸,加热有刺激性气味的气体生成。则该黑色物质与浓硫酸共热的化学反应方程式为。
(5)往(4)所得滤液中加澄清石灰水,溶液变浑浊。再滴入稀盐酸,溶液中有气泡出现。试写出钠与二氧化碳反应的化学方程式:。
某烃类化合物A的质谱图表明其相对分子质量为84,红外光谱表明分子中含有碳碳双键,核磁共振谱表明分子中只有一种类型的氢。
(1)A的结构简式为;
(2)A中的碳原子是否都处于同一平面?(填“是”或者“不是”);
(3)在下图中,D1、D2互为同分异构体,E1、E2互为同分异构体。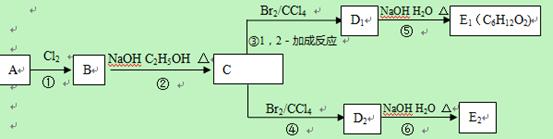
反应②的化学方程式为
;
C的化学名称为;
E2的结构简式是;
④、⑥的反应类型依次是
 、。
、。
A是一种含碳、氢、氧三种元素的有机化合物,已知:A相对分子质量为144,其中碳的质量分数为50%。A可以使溴水褪色。A难溶于水,但在酸性条件下可发生水解反应,得到B和甲醇。B中碳、氢、氧原子个数比为1:1:1,分子中没有支链,能与氢氧化钠溶液发生反应。
(1)A可以发生的反应有(选填编号)
① 加成反应② 酯化反应③ 加聚反应④ 氧化反应
(2)B分子所含官能团的名称是。
(3)与B具有相同官能团的同分异构体的结构简式是 _______________。
(4)由B制取A的化学方程式是:
。