下列反应的离子方程式书写正确的是
A.向Ba(OH)2溶液中加入NaHSO4溶液至刚好沉淀完全: Ba2++OH-+H++SO42-==BaSO4¯+H2O Ba2++OH-+H++SO42-==BaSO4¯+H2O |
B.Cu与浓H2SO4共热:Cu+4H++SO42- Cu2++SO2+2H2O Cu2++SO2+2H2O |
C.向FeSO4溶液中滴加H2O2溶液:Fe2++H2O2+2H+==Fe3++2H2O  |
D.将SO2通入Ca(ClO)2溶液:SO2+H2O+Ca2++2ClO-==CaSO3¯+2HClO |
据新华社2010年1月13日报道,中国驻海地维和部队在此次地震中有8人被埋,10从我失踪。……面对重大牺牲,中国有关部门表示将继续参与海地的维和活动。此材料表明新时期中国外交()
| A.积极参与以联合国为中心的多边外交 |
| B.积极参与地区性国际组织的外交活动 |
| C.始终坚持独立自主的和平外交方针 |
| D.欧盟集团受到二十国集团的挑战 |
2009年10月31日,被誉为“中国航天之父”、“中国导弹之父”的人民科学家钱学森不幸逝世,他曾荣获“两弹一星功勋奖章”。有关下列图片的叙述正确的是()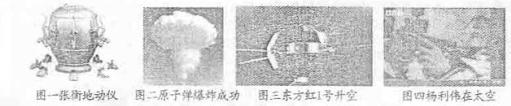
| A.图一反映了中国古代在预测地震方面取得了突出成就 |
| B.图二反映出中国为和平利用核能源作了卓越贡献 |
| C.图三反映出“文化大革命”促进了中国航天技术的发展 |
| D.图四反映出中国在载人航天领域已达到国际领先水平 |
2010年3月14日上午10时,温家宝总理在人民大会堂与采访十一届全国人大三次会议的中外记者见面并答记者问。言谈中,总理多次提到社会的公平正义,其中最让我们感觉温暖并视为经典的表述是总理在回答 新加坡《联合早报》记者提问时说的那段话——“……社会公平正义,是社会稳定的基础。我认为,公平正义比太阳还要有光辉”下列制度、法令中,既能维护社会和谐稳定,又能推进公平正义的是()
新加坡《联合早报》记者提问时说的那段话——“……社会公平正义,是社会稳定的基础。我认为,公平正义比太阳还要有光辉”下列制度、法令中,既能维护社会和谐稳定,又能推进公平正义的是()
①世卿世禄制②均田制
③九品中正制④罗斯福新政的“以工代赈”
| A.①②③ | B.②④ | C.①③④ | D.①②③④ |
2009年4月29日至30日,日本首相麻生太郎对中国进行正式访问,这是麻生就任日本首相后首次访华。麻生在访华期间谈到,日本前首相田中访华实现了中日邦交正常化,在中日之间架起了一座吊桥。当时推动这座“吊桥”建立的直接原因是()
| A.中国在联合国合法席位的恢复 | B.中日两国人民的友好交往 |
| C.中美关系改善并实现正常化 | D.中国综合国力的增强 |
毛泽东:“为人民服务”;邓小平:“我是中国人民的儿子,我的一切都是为了我的祖国和人民”;江泽民:“坚持立党为公,执政为民,坚持以人民群众为本,必须实现好、维护好、发展好最广大人民的根本利益。”材料体现的共同本质思想是()
| A.提高党和国家的执政能力 |
| B.代表最广大人民的根本利益 |
| C.中共党人集体智慧的结晶 |
| D.一脉相承而且与时俱进 |