有①Na2CO3溶液、②CH3COONa溶液、③NaOH溶液各25 mL,物质的量浓度均为0.1 mol/L,下列说法正确的是
| A.三种溶液pH的大小顺序是③>②>① |
| B.若将三种溶液稀释相同倍数,pH变化最大的是② |
| C.若分别加入25 mL 0.1mol/L盐酸后,pH最大的是① |
| D.若三种溶液的pH均为9,则物质的量浓度的大小顺序是③>①>② |
某含Cr2O72-废水用硫酸亚铁铵[FeSO4•(NH4)2SO4•6H2O]处理,反应中铁元素和铬元素完全转化为沉淀,该沉淀干燥后得到nmolFeO•FeyCrxO3(提示:其中Cr为+3价)。不考虑处理过程中的实际损耗,下列叙述错误的是
| A.消耗硫酸亚铁铵的物质的量为n(3x+l)mol |
| B.处理废水中Cr2O72-的物质的量为(nx/2)mol |
| C.反应中发生转移的电子的物质的量为6nxmol |
| D.在FeO•FeyCrxO3中3x=y |
利用右图所示装置进行下列实验,能得出相应实验结论的是
| 选项 |
① |
② |
③ |
实验结论 |
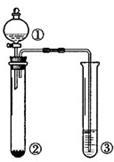 |
| A |
浓盐酸 |
MnO2 |
NaOH |
制氯气并吸收尾气 |
|
| B |
浓硫酸 |
蔗糖 |
溴水 |
浓硫酸具有脱水性、氧化性 |
|
| C |
稀盐酸 |
Na2SO3 |
Ba(NO3)2溶液 |
SO2与可溶性钡盐均可生成白色沉淀 |
|
| D |
浓硝酸 |
Na2CO3 |
Na2SiO3溶液 |
酸性:硝酸>碳酸>硅酸 |
X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76g/L;W的质子数是X、Y、Z、M四种元素质子数之和的1/2。下列说法正确的是
| A.原子半径:W>Z>Y>X>M |
| B.XZ2、X2M2、W2Z2均为直线型的共价化合物 |
| C.由X元素形成的单质不一定是原子晶体 |
| D.由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键 |
下列实验方案中,不能测定Na2CO3和NaHCO3混合物中Na2CO3质量分数的是
| A.取ag混合物充分加热,剩余bg固体 |
| B.取ag混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重bg |
| C.取ag混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得bg固体 |
| D.取ag混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得bg固体 |
右图中横坐标为加入反应物的物质的量,纵坐标为产生沉淀的物质的量。下列反应对应的曲线错误的是
| A.向NaAlO2溶液中滴入盐酸至过量 |
| B.向澄清石灰水中通入CO2至过量 |
| C.向含有盐酸的AlCl3溶液中滴入NaOH溶液至过量 |
| D.向含有等物质的量的Ca(OH)2、KOH的混合溶液中通入CO2至沉淀消失 |