下列叙述正确的是
| A.H2热值为142.9 kJ·g-1,则氢气燃烧的热化学方程式可表示为: 2H2(g)+ O2(g)= 2H2O(l)△H=-285.8kJ·mol-1 |
| B.Al3+、Cu2+、SO42-、F-能在溶液中大量共存 |
| C.硫酸亚铁溶液在空气中发生氧化反应:4 Fe2++ O2+4H+= 4 Fe3++2H2O |
| D.已知KSP(Ag2SO4)= 1.4×10—5,则向100mL0.01mol·L—1的Na2SO4溶液中加入1 mL0.01mol·L—1的AgNO3溶液,有白色沉淀生成 |
下列陈述Ⅰ、Ⅱ正确并且有因果关系的是
| 选项 |
陈述Ⅰ |
陈述Ⅱ |
| A |
二氧化硫和氯水有漂白性 |
两者都能使溴水褪色 |
| B |
硫酸铜可以用做游泳池消毒剂 |
铜盐能使蛋白质变性 |
| C |
盐酸和氨水能溶解氢氧化铝 |
氢氧化铝是两性氢氧化物 |
| D |
用淀粉-碘化钾溶液鉴别氯化亚铁 |
亚铁离子有氧化性 |
某学生鉴定甲盐的流程如图所示,下列说法正确的是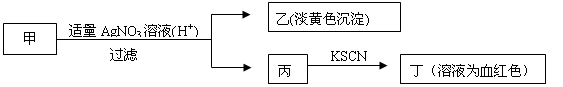
| A.如果甲中含有硫离子,则乙是硫磺沉淀 |
| B.如果乙是氯化银沉淀,那么甲是氯化铁 |
| C.丙中肯定含有铁离子,所以甲是溴化亚铁 |
| D.甲中含有铁元素,可能显示+2或者+3 |
下列各项内容中,排列顺序正确的是
①固体的热稳定性:Na2CO3>CaCO3>NaHCO3
②物质的熔点Li>Na>K
③微粒半径:K+>S2->F-
④单质的密度Na<K<Rb
⑤氢化物的沸点:H2Se>H2S> H2O
| A.①③ | B.②④ | C.①② | D.③⑤ |
固体NH5属于离子化合物。它与水反应的方程式为:NH5+H2O=NH3·H2O+H2,它也能跟乙醇发生类似的反应,并都产生氢气。下列有关NH5叙述正确的是
| A.与水反应时,水做氧化剂 |
| B.NH5中氮元素的化合价为+5价 |
| C.1molNH5中含有5NA个N-H键 |
| D.与乙醇反应时,NH5被还原 |
黄浦江上游水质污染较为严重,相关自来水厂采用多种方法并用的方式进行水质处理,下列说法中错误的是
| A.加活性炭吸附水中小颗粒物,净化水质的方法属于物理方法 |
| B.海水淡化的方法主要有蒸馏法、电渗析法、离子交换法等 |
| C.用细菌和酶的扩充法去除水中的氨氮的方法属于生物法 |
| D.用聚合硫酸铁作为净水剂,该处理过程中仅发生了化学变化 |