下列实验操作与预期实验目的或所得实验结论一致的是
| 选项 |
实验操作 |
实验目的或结论 |
| A |
某钾盐溶于盐酸,产生能使澄清石灰水变浑浊的无色无味气体 |
说明该钾盐是 |
| B |
向含有少量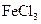 的 的 溶液中加入足量 溶液中加入足量 粉末,搅拌一段时间后过滤 粉末,搅拌一段时间后过滤 |
除去 溶液中少量 溶液中少量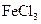 |
| C |
常温下,向饱和 溶液中加少量 溶液中加少量 粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生 粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生 |
说明常温下  |
| D |
 与浓硫酸170℃共热,制得的气体通人酸性 与浓硫酸170℃共热,制得的气体通人酸性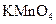 溶液 溶液 |
检验制得气体是否为乙烯 |
用我们日常生活中的食用白醋(醋酸浓度约为1 mol·L-1)进行下列实验,能证明醋酸为弱电解质的是
| A.白醋中滴入石蕊试液呈红色 |
| B.白醋加入豆浆中有沉淀产生 |
| C.经检验白醋中c(H+)约为0.01 mol·L-1 |
| D.蛋壳浸泡在白醋中有气体放出 |
对下列物质:①H2SO4、②CO2、 ③NaOH、④BaSO4、 ⑤NH3、⑥SO2、 ⑦NH3·H2O、⑧C2H5OH、⑨Cu、⑩氯化钠溶液。按要求分类不正确的是
| A.电解质:①、③、④、⑦ |
| B.弱电解质:④、⑦ |
| C.非电解质:②、⑤、⑥、⑧ |
| D.强电解质:①、③、④ |
将0.195 g锌粉加入到20.0 mL的0.100 mol·L-1MO2+溶液中,恰好完全反应,则还原产物可能是
| A.M | B.M2+ | C.M3+ | D.MO2+ |
下列操作过程中,利用物质的氧化性的是
| A.明矾净化水 | B.纯碱除去油污 |
| C.臭氧用于餐具消毒 | D.食醋清洗水垢 |
下列物质既是电解质又能导电的是
| A.NaCl晶体 | B.液态HCl | C.熔融的KNO3 | D.Na2SO4溶液 |