为了证明(NH4)2Fe(SO4)2·6H2O(硫酸亚铁铵晶体)的成分中含有NH、Fe2+、SO和H2O,下列实验叙述中不正确的是
| A.取少量硫酸亚铁铵晶体放入试管,加热,试管口有液体生成,则可证明晶体的成分中含有结晶水 |
| B.硫酸亚铁铵晶体溶于水,得淡绿色溶液,滴入2滴KSCN溶液,溶液不显红色,再滴入几滴新制氯水,溶液变为红色,则可证明晶体的成分中含有Fe2+ |
| C.硫酸亚铁铵晶体溶于水,加少量稀盐酸,无现象,再滴入几滴BaCl2溶液,有白色沉淀生成,则可证明晶体的成分中含有SO |
| D.取少量硫酸亚铁铵晶体放入试管,加浓NaOH溶液,加热,试管口湿润的蓝色石蕊试纸变红,则可证明晶体的成分中含有NH |
如下图所示,下列叙述正确的是( )。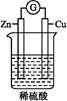
| A.铜是负极,铜片上有气泡产生 |
| B.铜片质量逐渐减少 |
| C.电流从锌片经导线流向铜片 |
| D.氢离子在铜片表面被还原 |
关于原电池的叙述中正确的是( )。
| A.任何化学反应,均可以设计成原电池 |
| B.原电池是把化学能直接转化成电能的装置 |
| C.原电池的两极必须都是金属 |
| D.原电池都可以提供持续稳定的电流,应用十分广泛 |
已知反应H2(g)+Br2(l)=2HBr(g)在25 ℃、101 kPa下进行,放出热量为72 kJ,蒸发1 mol Br2(l)需要吸收的能量为30 kJ,其他相关数据如下表:
| H2(g) |
Br2(g) |
HBr(g) |
|
| 1 mol分子中的化学键断裂时需要吸收的能量/kJ |
436 |
a |
369 |
则表中a为( )。
A.404 B.260 C.230 D.200
航天飞机用铝粉与高氯酸铵(NH4ClO4)的混合物为固体燃料,点燃时铝粉氧化放热引发高氯酸铵反应,其方程式可表示为2NH4ClO4=N2↑+4H2O+Cl2↑+2O2↑+热量,对此反应下列叙述中错误的是( )。
| A.上述反应属于分解反应 |
| B.上述反应瞬间产生大量高温气体推动航天飞机飞行 |
| C.从能量变化来说,主要是化学能转变为动能和热能 |
| D.反应中高氯酸铵只作氧化剂 |
在研究物质变化时,人们可以从不同的角度、不同的层面来认识物质变化时所引起的化学键及能量变化,据此判断以下叙述中错误的是( )。
| A.金属钠与氯气反应生成氯化钠后,其结构的稳定性增强,体系的能量降低 |
| B.物质燃烧可看成“储存”在物质内部的能量(化学能)转化为热能释放出来 |
| C.氮分子内部存在着很强的共价键,故通常状况下氮气化学性质很活泼 |
| D.需要加热才能发生的反应不一定是吸收能量的反应 |