化学反应可视为旧化学键断裂和新化学键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是a kJ·mol-1,H—H键的键能是b kJ·mol-1;由N2和H2合成1 mol NH3时可放出c kJ的热量。那么N—H 键的键能是
| A.(a+3b-2c)/2 kJ·mol-1 | B.(a+3b+2c)/6 kJ·mol-1 |
| C.(a+3b-2c)/6 kJ·mol-1 | D.(a+3b+2c)/3 kJ·mol-1 |
室温时,下列混合溶液的pH一定小于7的是()
| A.pH=3的盐酸和pH=11的氨水等体积混合 |
| B.pH=3的盐酸和pH=11的氢氧化钡等体积混合 |
| C.pH=3的醋酸和pH=11的氢氧化钡等体积混合 |
| D.pH=3的硫酸和pH=11的氨水等体积混合 |
汽车的启动电源常用铅蓄电池,放电时的电池反应如下:PbO2 + Pb + 2H2SO4 = 2PbSO4+ 2H2O,根据此反应判断下列叙述中正确的是()
| A.PbO2是电池的负极 |
B.负极的电极反应式为:Pb + SO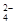 – 2e – = PbSO4 – 2e – = PbSO4 |
| C.PbO2得电子,被氧化 |
| D.电池放电时,溶液酸性增强 |
MOH和ROH两种碱的溶液分别加水稀释时,pH变化如图所示。下列叙述中正确的是()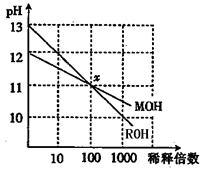
| A.MOH是一种强碱 |
| B.在x点,MOH完全电离 |
| C.在x点,c(M+)==c(R+) |
| D.稀释前,c(ROH)==10c(MOH) |
已知:C(s)+CO2(g) 2CO(g) △H>0。该反应达到平衡后,下列条件有利于反应向正方向进行的是()
2CO(g) △H>0。该反应达到平衡后,下列条件有利于反应向正方向进行的是()
| A.升高温度和减小压强 | B.降低温度和减小压强 |
| C.降低温度和增大压强 | D.升高温度和增大压强 |
对于可逆反应C(s)+H2O(g) 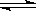 CO(g)+H2(g),在一定温度下达到平衡时,其平衡常数表达式正确的是()
CO(g)+H2(g),在一定温度下达到平衡时,其平衡常数表达式正确的是()
A.K=[c(C)·c(H2O)]/ [c(CO)·c(H2)] B.K= [c(CO)·c(H2)]/ [c(C)·c(H2O)]
C.K=[c(H2O)]/ [c(CO)·c(H2)] D.K=[c(CO)·c(H2)/ [c(H2O)]]