下列变化中不需要破坏化学键的是
| A.加热氯化铵 | B.干冰升华 | C.氯化钠熔化 | D.氯化氢溶于水 |
化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是
| A.电解饱和食盐水时,阳极的电极反应式为:2Cl - -2e -==Cl2 ↑ |
| B.氢氧燃料电池的负极反应式:O2 + 2H2O+ 4e- ="=" 4OH - |
| C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e- ="=" Cu2+ |
| D.钢铁发生电化学腐蚀的正极反应式:Fe-2e - ="=" Fe2+ |
下列能级符号正确的是
| A.6s | B.2d | C.1p | D.3f |
在体积不变的密闭容器中充入lmol NH3,建立平衡:2NH3 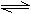 3H2+N2,测得NH3的分解率为x%。若在其他条件不变时,再充入lmol NH3,待建立新的平衡后,又测得NH3的分解率为y%,则x和y的正确关系为( )
3H2+N2,测得NH3的分解率为x%。若在其他条件不变时,再充入lmol NH3,待建立新的平衡后,又测得NH3的分解率为y%,则x和y的正确关系为( )
| A.x>y | B.x<y | C.x=y | D.x≥y |
下列是一系列α-氨基酸:
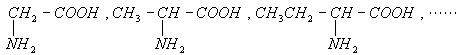
该系列中碳元素的质量分数的最大值接近于( )
| A.32% | B.46.6% | C.85.7% | D.92.3% |
下列实验装置、试剂选用或操作正确的是 ( )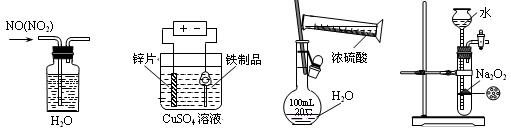
| A.除去NO中的NO2 | B.铁制品表面镀锌 | C.稀释浓硫酸 | D.制备少量O2 |