下列物质的性质与氢键无关的是
| A.冰的密度比液态水的密度小 | B.通常情况NH3极易溶于水 |
| C.NH3分子比PH3分子稳定 | D.在相同条件下,H2O的沸点比H2S的沸点高 |
[双选题]实验室用锌粒与2 mol·L-1硫酸溶液制取氢气,下列措施不能增大化学反应速率的是( )
| A.向该硫酸溶液中加入等体积的水 |
| B.改用3 mol·L-1盐酸 |
| C.改用热的2 mol·L-1硫酸溶液 |
| D.用锌粉代替锌粒 |
下列关于判断过程的方向的说法正确的是( )
| A.所有自发进行的化学反应都是放热反应 |
| B.高温高压下可以使石墨转化为金刚石的过程是自发过程 |
| C.综合考虑焓变和熵变将更适合于所有的过程 |
| D.同一物质的固、液、气三种状态的熵值相同 |
以KCl和ZnCl2混合液为电镀液在铁制品上镀锌,下列说法正确的是( )
| A.未通电前上述镀锌装置可构成原电池,电镀过程是该原电池的充电过程 |
| B.因部分电能转化为热能,电镀时通过的电量与锌的析出量无确定关系 |
| C.电镀时保持电流恒定,升高温度不改变电解反应速率 |
| D.镀锌层破损后即对铁制品失去保护作用 |
2010年10月1日,我国在西昌卫星发射中心成功发射“嫦娥二号”。嫦娥二号火箭推进器以联氨(N2H4)为燃料、过氧化氢为助燃剂。已知下列各物质反应的热化学方程式为
N2H4(g)+O2(g)=N2(g)+2H2O(g);ΔH1=-533.23 kJ·mol-1
H2O(g)=H2O(l);ΔH2=-44 kJ·mol-1
2H2O2(l)=2H2O(l)+O2(g);ΔH3=-196.4 kJ·mol-1
则联氨与过氧化氢反应的热化学方程式可表示为( )
| A.N2H4(g)+2H2O2(l)=N2(g)+4H2O(l);ΔH=+817.63 kJ·mol-1 |
| B.N2H4(g)+2H2O2(l)=N2(g)+4H2O(g);ΔH=-641.63 kJ·mol-1 |
| C.N2H4(g)+2H2O2(l)=N2(g)+4H2O(l);ΔH=-641.63 kJ·mol-1 |
| D.N2H4(g)+2H2O2(l)=N2(g)+4H2O(g);ΔH=-817.63 kJ·mol-1 |
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为3Zn+2K2FeO4+8H2O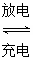 3Zn(OH)2+2Fe(OH)3+4KOH。关于该电池的说法正确的是( )
3Zn(OH)2+2Fe(OH)3+4KOH。关于该电池的说法正确的是( )
| A.放电时,Zn作负极,发生还原反应 |
| B.放电时,K2FeO4附近溶液pH减小 |
| C.充电时,锌极附近溶液pH减小 |
| D.充电时,阳极电极反应为: |
Fe(OH)3-3e-+5OH-=FeO +4H2O
+4H2O