下表是元素周期表的一部分。表中所列字母分别代表一种化学元素。
| a |
|
|
|||||||||||||||
| b |
|
|
|
c |
d |
e |
f |
|
|||||||||
| g |
h |
i |
j |
|
k |
l |
m |
||||||||||
| n |
|
|
|
|
|
|
o |
|
 |
|
|
|
|
|
|
|
|
试回答下列问题:
(1)请写出元素O的基态原子电子排布式 。
(2)第三周期8种元素按单质熔点高低的顺序如图,其中序号“8”代表 (填元素符号);其中电负性最大的是 (填图中的序号),第一电离能最大的是 (填图中的序号)。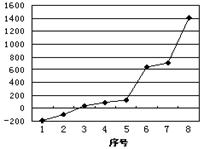
(3)由j原子跟c原子以1 : 1相互交替结合而形成的晶体,晶体类型与晶体j相同。两者相比熔点更高的是 (填化学式),试从结构角度加以解释 。
(4)COCl2俗称光气,分子中C原子采取 杂化成键;分子中的共价键含有 (填标号)
a.2个σ键 b.2个π键 c.1个σ键、2个π键 d.3个σ键、1个π键
化合物E是一种医药中间体,常用于制备抗凝血药,可以通过下图所示的路线合成:
(1)A中含有的官能团名称为,C转化为D的反应类型是。
(2)1mol E最多可与mol H2反应;写出D与足量NaOH溶液完全反应的化学方程式:。
(3)写出同时满足下列条件的B的一种同分异构体的结构简式。
A.能够发生银镜反应,也能发生水解反应
B.分子内只含四种不同化学环境氢原子
C.能与FeCl3溶液发生显色反应
(4)若将D与过量NaOH溶液加热充分反应后再蒸干、灼烧,最后容器中残留的固体物质为。
某化学兴趣小组用只含有铝、铁、铜的工业废料制取纯净的氯化铝溶液、绿矾晶体(FeSO4·7H2O)和胆矾晶体,以探索工业废料的再利用。其实验方案如下: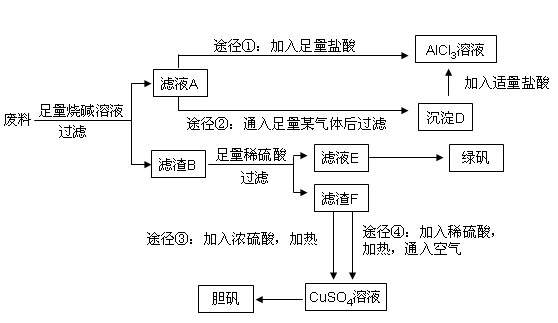
(1)写出合金与烧碱溶液反应的离子方程式:。
(2)由滤液A制AlCl3溶液的途径有①和②两种,途径②中通入的某气体(固态时可用于人工降雨),写出该气体的电子式。你认为较合理的途径是(填①或②),理由是:。
(3)滤液E若放置在空气中一段时间后,溶液中的阳离子除了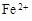 和
和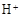 外,还可能存在(用离子符号表示),检测该离子的方法是。
外,还可能存在(用离子符号表示),检测该离子的方法是。
(4)用滤渣F通过两种途径制取胆矾,与途径③相比,途径④明显具有的两个优点是:、。
(5)途径④发生的反应的化学方程式为:。
(6)实验室从CuSO4溶液制取胆矾,操作步骤有蒸发浓缩、冷却结晶、、自然干燥。
(甲醇是重要的化学工业基础原料和清洁液体燃料,它广泛用于有机合成、医药、农药、涂料、染料、汽车和国防等工业中。工业上一般在恒容密闭容器中采用下列反应合成甲醇:
CO(g)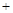 2H2(g)
2H2(g)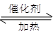 CH3OH(g)
CH3OH(g)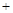 Q
Q
下表所列数据是反应在不同温度下的化学平衡常数(K)。
| 温度 |
250℃ |
300℃ |
350℃ |
| K |
2.041 |
0.270 |
0.012 |
(1)判断反应达到平衡状态的依据是()
A.混合气体的密度不变
B.混合气体的平均相对分子质量不变
C.生成CH3OH的速率与消耗CO的速率相等
D.CH3OH、CO、H2的浓度都不再发生变化
(2)由表中数据判断Q0 (填“>”、“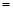 ”或“<”),要提高CO转化率,可采取的措施
”或“<”),要提高CO转化率,可采取的措施
是()
A.加入催化剂 B.充入CO C.充入H2 D.升温
(3)某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应10min后,达到平衡时测得c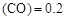 mol/L,则以CH3OH表示的反应速率v
mol/L,则以CH3OH表示的反应速率v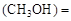 mol /(L·min),
mol /(L·min),
CO的转化率为。
(4)原料CO和H2可以由C和H2O反应制取,涉及的反应方程式如下:
C(s)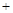 CO2(g)
CO2(g)  2CO(g)平衡常数K1
2CO(g)平衡常数K1
C(s)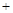 H2O(g)
H2O(g)  CO(g)
CO(g)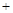 H2(g)平衡常数K2
H2(g)平衡常数K2
CO(g)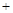 H2O(g)
H2O(g)  H2(g)
H2(g)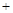 CO2(g)平衡常数K3
CO2(g)平衡常数K3
则K1、K2、K3之间的关系是:。
为了防止枪支生锈,常将枪支的钢铁零件放在NaNO2和NaOH的混合液中进行化学处理使钢铁零件表面生成Fe3O4的致密的保护层——“发蓝”。其过程可用下列化学方程式表示:
①3Fe NaNO2
NaNO2 5NaOH → 3Na2FeO2
5NaOH → 3Na2FeO2 H2O
H2O NH3↑
NH3↑
②Na2FeO2 NaNO2
NaNO2 H2O →Na2Fe2O4
H2O →Na2Fe2O4 NH3↑
NH3↑ NaOH
NaOH
③Na2FeO2 Na2Fe2O4
Na2Fe2O4 2H2O
2H2O Fe3O4
Fe3O4 4NaOH
4NaOH
(1)配平化学方程式②。
(2)上述反应①中还原剂为,被还原的是。若有1mol Na2FeO2生成,则反应中有mol电子转移。
(3)关于形成“发蓝”的过程,下列说法正确的是…………………………………………()
| A.该生产过程不会产生污染 | B.反应③生成的四氧化三铁具有抗腐蚀作用 |
| C.反应①②③均是氧化还原反应 | D.反应①②中的氧化剂均为NaNO2 |
(4)当NaOH溶液浓度过大,“发蓝”的厚度会变小,其原因是:。
已知由有机物B、苯甲醛、乙酸、乙醇合成目标产物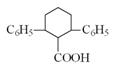 ,其合成路线如下图所示(其中Et表示乙基)。
,其合成路线如下图所示(其中Et表示乙基)。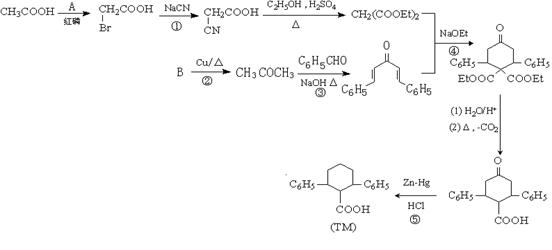
完成下列填空:
(1)写出反应类型:反应④、反应⑤
(2)写出物质A的分子式________ ,B的名称是。
(3)写出下列反应的化学方程式:
②____________________________________________________________。
③___________________________________________________________。
(4)C9H10O是苯甲醛的同系物,其中苯环上含有两个取代基的同分异构体共有____种,写出
其中一种的结构简式_____________________。
(5)如果只用一种试剂通过化学反应(必要时可以加热)鉴别合成原料中的乙酸、乙醇、苯甲醛。这种试剂是______________,其中苯甲醛检出的现象是_______________________。
(6)目标产物(结构如图)是否有含三个苯环的同分异构体____(填“有”或“无”),理由是__________________。