下表是周期表中的一部分,根据A—K在周期表中的位置,按要求回答下列问题:
 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 1 |
A |
|
|
|
|
|
|
|
| 2 |
|
|
|
B |
C |
|
D |
|
| 3 |
E |
F |
G |
H |
I |
J |
K |
|
(1)上表A—K元素中,只有负价而无正价的元素是(写出元素名称,下同) ,金属性最强的元素是 ,原子半径最小的元素是
(2)比较D-、E+及K-的离子半径,由大到小的顺序为:
(3) 气态氢化物最稳定的是(填物质的化学式)  。写出元素 C、K的气态氢化物相互反应的现象 ,反应化学方程式为: 。
。写出元素 C、K的气态氢化物相互反应的现象 ,反应化学方程式为: 。
(4) (本小题均填物质的化学式)在最高价氧化物的水化物中,碱性最强的是(填物质的化学式,下同) ,酸性最强的是 ,呈两性的是 ,写出元素E、K的最高价氧化物对应水化物相互反应的离子方程式为
碘是人体不可缺少的元素,为了防止碘缺乏,现在市场上流行一种加碘盐,就是在精盐中添加一定量的KIO3进去。某研究小组为了检测某加碘盐中是否含有碘,查阅了有关的资料,发现其检测原理是:在溶液中 KIO3+5KI+3H2SO4=3I2+3H2O+3K2SO4
(1)用双线桥表示该反应中电子转移的方向和数目
该反应中还原产物与氧化产物的物质的量比是__________,0.2mol KIO3参加反应时转移电子__________mol
(2)实验结束后分离I2和K2SO4溶液所用的试剂是________
A.CCl4B.酒精C.Na2SO4溶液 D.食盐水
所用的分离方法是 ,所用主要玻璃仪器是
(3)上面实验中用到一定物质的量浓度的稀硫酸,若配制1 mol/L的稀硫酸溶液480mL,需用18mol/L浓H2SO4 mL,配制中需要用到的主要玻璃仪器是(填序号) .
A 100mL量筒 B 托盘天平
C 玻璃棒 D 100mL容量瓶
E 50mL 量筒 F 胶头滴管 G 烧杯 H 500mL容量瓶
(4)下面操作造成所配稀硫酸溶液浓度偏高的是___________
A.溶解后溶液没有冷却到室温就转移
B.转移时没有洗涤烧杯、玻璃棒
C.向容量瓶加水定容时眼睛俯视液面
D.用量筒量取浓硫酸后洗涤量筒并把洗涤液转移到容量瓶
E.摇匀后发现液面低于刻度线,又加蒸馏水至刻度线
如图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题。
(1)指出图中的两处明显的错误: ; 。
(2)A仪器的名称是 ,B仪器的名称是 。
(3)实验时A中除加入少量自来水外,还需加入少量 ,其作用是 。
某实验小组用工业上废弃固体(主要成分Cu2S和Fe2O3)混合物制取粗铜和Fe2(SO4)3晶体,设计的操作流程如下: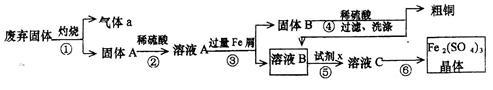
(1)除酒精灯和铁架台(或三脚架)外,①中所需的容器为__________;①和⑥中都用到的玻璃仪器为________________;
(2)已知试剂x为过氧化氢,写出H2O2与溶液B反应的离子方程式_______________________;
(3)某同学取少量的溶液B向其中加入过量的某种强氧化剂,再滴加KSCN溶液,发现溶液变红色,放置一段时间后,溶液褪色,该同学猜测溶液褪色的原因是溶液中的SCN-被过量的氧化剂氧化所致。
现给出以下试剂:1.0 mol·L-1硫酸、1.0 mol·L-1NaOH溶液、0.1 mol·L-1Fe2(SO4)3;溶液、20%KSCN溶液、蒸馏水。请你设计合理实验验证该同学的猜测是否合理。简要说明实验步骤和现象________________。
人体血液里Ca2+离子的浓度一般采用g/cm3来表示。抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度:
【配制KMnO4标准溶液】下图是配制50mLKMnO4标准溶液的过程示意图。
(1)上述过程中有两处错误,请你观察图示,判断其中不正确的操作是(填序号)____________;
(2)如果按照图示的操作配制溶液,所得的实验结果将____________(填偏大或偏小)。
【测定血液样品中Ca2+的浓度】抽取血样20.00mL,经过上述处理后得到草酸,再用硫酸酸化的0.020mol/L KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00mL KMnO4溶液。
(3)滴定时,盛放高锰酸钾器名称为________________,确定反应达到终点的现象________________。
(4)草酸跟酸性KMnO4溶液反应的离子方程式为:_______________________。
(5)根据所给数据计算血液样品中Ca2+离子的浓度为________mg/cm3。
表示溶液浓度的方法通常有两种:溶液中溶质的质量分数(ω)和物质的量浓度(c),因此在配制溶液时,根据不同的需要,有不同的配制方法。请完成下列填空题。
(1)用10%(密度为1.00g·cm-3)的NaOH溶液配制成27.5g2%的NaOH溶液。
①计算:需__________g10%(密度为1.00g·cm-3)的NaOH溶液,需加__________mL水(密度为1.00g·cm-3)进行稀释。
②量取:用___________mL量筒(供选择的量筒规格有:5mL、10mL、25mL、50mL)量取10%的NaOH溶液,量取时视线要跟量筒内液体凹液面最低处相切,然后倒入烧杯里,用25mL量筒量取蒸馏水注入烧杯里。
(2)把98%(密度为1.84g·cm-3)的浓硫酸稀释成3mol/L的稀硫酸100mL,回答下列问题:
①需要量取浓硫酸___________mL(保留一位小数)。
②配制操作可分解成如下几步,正确的操作顺序是:___________。
| A.向容量瓶中注入少量蒸馏水,检查是否漏水 |
| B.用少量蒸馏水洗涤烧杯及玻璃棒,将洗涤液注入容量瓶中,并重复操作两次 |
| C.把已冷却的稀硫酸注入经检查不漏水的容量瓶中 |
| D.根据计算,用量筒量取一定体积的浓硫酸 |
E.将浓硫酸沿烧杯壁慢慢注入盛有蒸馏水的小烧杯中,并不断用玻璃棒搅拌
F.盖上容量瓶的塞子,振荡,摇匀
G.用胶头滴管滴加蒸馏水,使液面达到刻度线
H.继续往容量瓶中加蒸馏水,使液面接近刻度线
③如果上述C操作中把未冷却的稀硫酸注入容量瓶中,所配溶液的浓度将_________ (填“偏高”、“偏低”或“无影响”,下同);如果上述D操作中量取浓硫酸后量筒内滞留的浓硫酸用少量蒸馏水洗涤并将洗涤液转入E操作中的小烧杯中,所配溶液的浓度将_________;如果上述D操作中目光俯视,所配溶液的浓度将_________。