为了证明铜与稀硝酸反应产生的是NO,某校学生实验小组设计了一个实验,其装置如下图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的打气球。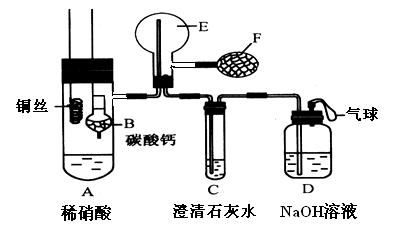
(1)实验时,第一步实验操作为:将装有CaCO3干燥管下移与稀硝酸反应生成CO2,该操作作用为 。反应的化学方程式为 。
从装置的设计看,确定E中空气已被赶尽的实验现象是
。
(2)第二步,提起干燥管B, 将A中铜丝放入稀硝酸中,给装置A微微加热,在装置A中产生无色气体,其反应的离子方程式为 。有人认为E中收集到的可能是H2而不是NO,如何证明?
。
(3)实验过程中,发现在未鼓入空气的情况下,E中就产生红棕色。有人认为是由装置E部分设计不当造成的。你认为装置应改进的地方是 。
(4)装置D的作用是 。
(5)将一定量铜与足量稀硝酸充分反应,可以得到4.48L NO气体(气体体积在标准状况下测定),若反应后溶液体积为100mL,则所得溶液中Cu2+的物质的量浓度是
成熟的苹果中含有淀粉、葡萄糖和无机盐等,某课外兴趣小组设计了一组实验证明某些成份的存在,请你参与并协助他们完成相关实验。
(1)用小试管取少量的苹果汁,加入碘水,溶液变蓝,则苹果中含有(分子式)。
(2)用小试管取少量的苹果汁,加入新制Cu(OH)2悬浊液,并加热,产生沉淀(填颜色),则苹果中含有 (写分子式)。
(3)葡萄糖在一定条件下可以得到化学式为C2H6O的化合物A:A + CH3COOH→有香味的产物写出化合物A与CH3COOH反应的化学方程式为 ,该反应的类型为
如图所示,用甲醇和氧气以及强碱做电解质溶液的新型燃料电池做电源,对A、B装置通电一段时间后,发现有1.6g甲醇参加反应且③电极增重(假设工作时无能量损失)。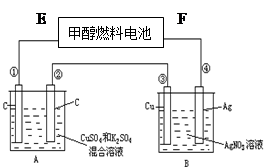
请回答下列问题:
(1)分别指出F电极、②电极的名称、。
(2)④电极的反应式:。E电极的反应式:。
①电极上产生的实验现象是。
(3)若A池中原混合液的体积为500 mL,CuSO4、K2SO4浓度均为0.1 mol/L,电解过程中A池中共收集到标准状况下的气体L。
(10)按要求完成硝酸钾晶体的制备实验:
| 步骤 |
操作 |
具体操作步骤 |
现象解释结论等 |
① |
溶解 |
取20克NaNO3和17克KCl溶解在35ml水中,加热至沸,并不断搅拌。 |
固体溶解 |
| ② |
蒸发 |
继续加热搅拌,使溶液蒸发浓缩。 |
有a晶体析出。 |
| ③ |
热过滤 |
当溶液体积减少到约原来的一半时,迅速趁热过滤 |
滤液中的最主要成分为b。 |
| ④ |
冷却 |
将滤液冷却至室温。 |
有晶体析出。 |
 ⑤ ⑤ |
按有关要求进行操作 |
得到初产品硝酸钾晶体 |
|
| ⑥ |
将得到的初产品硝酸钾晶体溶于适量的水中,加热、搅拌,待全部溶解后停止加热,使溶液冷却至室温后抽滤。 |
得到纯度较高的硝酸钾晶体 |
|
| ⑦ |
检验 |
分别取⑤、⑥得到的产品,配置成溶液后分别加入1滴1mol/l的HNO3和2滴0.1mol/l的AgNO3 |
可观察到⑤、⑥产品中出现的现象分别是⑤产品中产生白色沉淀,⑥产品中无明显现象。 |
(1)把上述各步骤中的内容补充完整:a: b:
(2)写出步骤③趁热过滤的目的,步骤⑥的操作名称,步骤⑦中产生白色沉淀的离子方程式
(3)步骤⑥的抽滤装置如图所示,仪器A的名称,该装置中的错误之处是;抽滤完毕或中途需停抽滤时,应先,然后。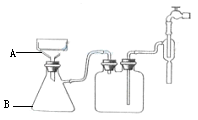
某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实现象如下表:
| 实验方案 |
实验现象 |
| ①用砂纸擦后的镁带与沸水反应,再向反应后溶液中滴加酚酞 |
(A)浮于水面,熔成一个小球,在水面上无定向移动,随之消失,溶液变红色 |
| ②向新制的H2S饱和溶液中滴加新制的氯水 |
(B)产生气体,可在空气中燃烧,溶液变成浅红色 |
| ③钠与滴有酚酞试液的冷水反应 |
(C)反应不十分强烈,产生无色气体 |
| ④镁带与2 mol•L-1的盐酸反应 |
(D)剧烈反应,产生无色气体 |
| ⑤铝条与2 mol•L-1的盐酸反应 |
(E)生成白色胶状沉淀,既而沉淀消失 |
| ⑥向AlCl3溶液中滴加NaOH溶液至过量 |
(F)生成淡黄色沉淀 |
请你帮助该同学整理并完成实验报告:
(1)实验目的: 。
(2)实验用品:
仪器:试管、酒精灯、砂纸、镊子、小刀、胶头滴管、滤纸
药品:镁带、钠、铝条、新制氯水、新制饱和硫化氢溶液、2 mol•L-1的盐酸、NaOH溶液、蒸馏水、酚酞、AlCl3溶液
(3)实验内容:(填写题给信息表中的序号)
| 实验方案 |
实验现象(填写序号) |
| ① |
|
| ② |
|
| ③ |
|
| ④ |
|
| ⑤ |
|
| ⑥ |
(4)实验结论: 。
(5)请你补充简单易行的实验方案,证明此周期中另外两种元素的性质递变规律。
某化学研究小组将锌片和铜片插入某种电解质溶液,锌片和铜片用导线相连,形成原电池装置。
(1)若电解质溶液是稀硫酸,则发生氧化反应的是 极(填“锌”或“铜”,下同),溶液中的H+ 移向 极,铜极上的电极反应式是 。
(2)若电解质溶液是硫酸铜溶液,铜极上的电极反应式是 ,若反应过程中有0.2mol电子发生转移,则电解质溶液质量增加 g。