Ⅰ、恒温、恒压下,在一个可变容积的容器中发生如下反应: N2(g)+3H2(g)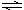 2NH3(g);△H<0
2NH3(g);△H<0
(1)工业生产中,该反应通常在高压下进行反应,做出此选择的理由是:
① ;
② 。
(2)开始时放入1mol N2和3mol H2,到达平衡后,生成amol NH3,若开始时放入χmol N2、3mol H2和y mol NH3,到达平衡后,NH3的物质的量为 3amol,则x= mol,y= mol。
Ⅱ、若该容器恒压、绝热(与外界不发生热交换),在一个与(2)反应前起始条件完全相同的容器中发生上述反应
(3)若开始时放入1mol N2和3mol H2,到达平衡后,生成b mol NH3,将b与(2)小题中的a进行比较 (选填一个编号)
(甲)a<b (乙)a>b (丙)a=b (丁)不能比较a和b的大小
作出此判断的理由是 。
Ⅲ、某研究性学习小组为探究利用电化学原理合成氨,设计如图所示的装置,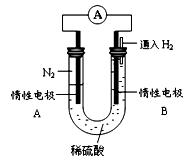
(4)电极B为 极
(5)电极A发生的电极反应式为
(6)该电池工作一段时间后,电解质溶液pH (填增大、减小或不变)
配制500 mL 0.1 mol·L-1碳酸钠溶液:
(1)应该用托盘天平称取碳酸钠晶体(Na2CO3·10H2O)_______g。
(2)在称量碳酸钠晶体(Na2CO3·10H2O)时,一位同学将砝码与晶体位置放颠倒了(1 g以下使用游码),则平衡后实际称得的样品质量是_______。
配制500 mL 1 mol·L-1 NaCl溶液时,下列操作会使实验结果偏高的是______________,偏低的是______________,无影响的是______________。
| A.振荡、摇匀溶液后,发现液面低于刻度线,再补加水 |
| B.称量时,固体放在右盘,砝码放在左盘(未用游码) |
| C.原容量瓶洗涤后未干燥 |
| D.移液时,未洗涤烧杯和玻璃棒 |
E.定容时,俯视刻度线
A和B反应生成C,假定反应由A、B开始,它们的起始浓度均为1mol/L。反应进行2min后A的浓度为0.8mol/L,B的浓度为0.6mol/L,C的浓度为0.6mol/L。则2min内反应的平均速率υA=__________,υB=_____________,υC=___________。该反应的化学反应方程式为 。
如图所示,合成氨反应:N2(g)+3H2(g) 2NH3(g)△H<0。在某一时间段t0~t6中反应速率与反应过程的曲线图。试回答下
2NH3(g)△H<0。在某一时间段t0~t6中反应速率与反应过程的曲线图。试回答下
列问题:
⑴合成氨反应已达平衡状态的时间段为:。
⑵t1~t2时间段是改变的条件使平衡向方向移动;t4~t5时间段是改变的条件使平衡向方向移动。
⑶在此过程中,氨的百分含量最高的一段时间是。
在某温度下,A+B 2C反应达到化学平衡。
2C反应达到化学平衡。
(1)升高温度时,C的物质的量浓度减小,则正反应是 热反应,υ(正) ,
υ(逆) (“减慢”或“加快”),平衡向 移动。
(2)若B为气态,增大压强平衡不发生移动,则A是 态,C是 态。
(3)若增减B的量,平衡不发生移动,则B是 态。