下列实验装置设计错误,不能达到目的的是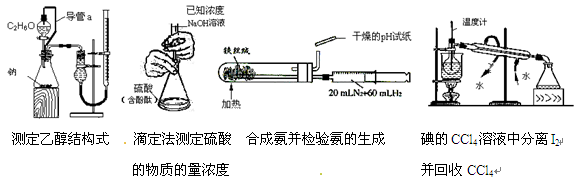
A B C D
关于反应中的先后顺序,下列评价正确的是()
| A.向浓度都为0.1 mol·L-1Na2CO3和NaOH混合溶液中通入CO2,NaOH首先反应 |
| B.向NH4Al(SO4)2溶液中滴加少量的NaOH溶液,NH首先反应 |
| C.向浓度都为0.1 mol·L-1的FeCl3和CuCl2混合溶液中加入铁粉,CuCl2首先反应 |
| D.向0.1 mol·L-1的FeCl3溶液中加入质量相同、颗粒大小相同的铁和铜,铜首先反应 |
某研究小组通过实验探究Cu及其化合物的性质,下列操作正确且能达到目的的是()
| A.将铜丝插入浓硫酸中加热,反应后把水加入反应器中,观察硫酸铜溶液的颜色 |
| B.常温下将铜丝伸入盛满氯气的集气瓶中,观察CuCl2的生成 |
| C.将CuCl2溶液在蒸发皿中加热蒸干,得到无水CuCl2固体 |
| D.将表面有铜绿[Cu2(OH)2CO3]的铜器放入盐酸中浸泡,除去铜绿 |
下列各组物质中,不能按如图所示关系一步完成转化的是()
| A |
B |
C |
D |
|
| a |
CO2 |
H2SO4 |
Al(OH)3 |
HNO3 |
| b |
Na2CO3 |
SO2 |
NaAlO2 |
NO |
| c |
NaHCO3 |
SO3 |
Al2O3 |
NO2 |
依据下表所列实验及现象得出的结论不正确的是()
| 实验项目 |
实验现象 |
| FeCl3溶液中加入维生素C(VC) |
溶液褪色为浅绿色 |
| 饱和FeCl3溶液滴入沸水中 |
得到红褐色液体 |
| 将铜锈放入盐酸中 |
有无色气泡产生 |
A.维生素C(VC)具有还原性
B.FeCl3水解生成Fe(OH)3胶体
C.铜锈与盐酸反应有H2生成
D.铜锈中含有碳酸根
下列说法正确的是()
| A.实验室常用铝盐溶液与氢氧化钠溶液制备Al(OH)3沉淀 |
| B.将Na投入到NH4Cl溶液中只能生成一种气体 |
| C.过量的铜与浓硝酸反应有一氧化氮生成 |
| D.饱和石灰水中加入少量CaO,恢复至室温后溶液的pH改变 |