常温下,用 0.1000 mol/LNaOH溶液逐滴加入到 20.00mL 0.1000 mol/LCH3COOH溶液所得滴定曲线如图。下列说法正确的是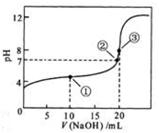
| A.点①的左端溶液可能存在:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+) |
| B.①②之间(不含两点)所示溶液中:c(Na+)=c(CH3COOH)+ c(CH3COO-) |
| C.点③之后所示溶液中:c(CH3COOH)+c(H+)=c(OH-) |
| D.过程中可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-) |
常温,某强酸溶液pH=a,强碱溶液pH=b,已知a+b=12,酸碱溶液混合pH=7,则酸溶液体积V(酸)和碱溶液体积V(碱)的正确关系为()
| A.V(酸)=102V(碱) | B.V(碱)=102V(酸). |
| C.V(酸)=2V(碱) | D.V(碱)=2V(酸) |
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)==Zn(OH)2(s)+Mn2O3(s)
下列说法错误的是
| A.电池工作时,锌失去电子 |
| B.电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e—=Mn2O3(s)+2OH—(aq) |
| C.电池工作时,电子由正极通过外电路流向负极 |
| D.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g |
X元素的阴离子,Y元素的阴离子和Z元素的阳离子具有相同的电子层结构,已知X的原子序数比Y的大,则X、Y、Z的三种离子半径的大小顺序是(分别用r1、r2、r3表示)()
| A.r1 > r2 > r3 | B.r2> r1> r3 | C.r3 > r1 > r2 | D.r3 > r2 > r1 |
对于任何一个平衡体系,采用以下措施,一定会使平衡移动的是()
| A.加入一种反应物 | B.升高温度 |
| C.对平衡体系增加压强 | D.使用催化剂 |
下列说法中错误的是()
| A.凡是放热反应和熵增加的反应,就更易自发进行 |
| B.对于同一物质在不同状态时的熵值是:气态>液态>固态 |
| C.平衡常数K值越大,则可逆反应进行越完全,反应物的转化率也越大 |
| D.凡是能量达到活化能的分子发生的碰撞均为有效碰撞 |