根据元素周期表及周期律的知识回答下列问题:
(1)与钠同周期且离子半径最小的元素位于周期表的第________________族。其氧化物属于________晶体。
(2)金属钠在一定条件下与氢气反应生成氢化钠(2Na+H2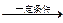 2NaH)。生成物氢化
2NaH)。生成物氢化
钠的电子式为_________,含有的化学键为_______键(填“离 子”、“共价”或“金属”)。
子”、“共价”或“金属”)。
(3)元素周期表中元素的性质存在递变规律,下列比较正确的是________。
a.碱性:NaOH>Mg(OH)2>Al(OH)3 b.酸性:H4SiO4>H3PO4>H2SO4>HClO4
c.氢化物稳定性:PH3<H2S<HCl d.与NaOH溶液反应的剧烈程度:Na>Mg>Al
(4)第三周期元素的气态原子失去最外层一个电子所需能量(设为E)如图所示: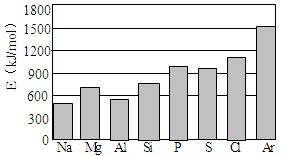
① 同周期内,随着原子序数的增大,E值变化的总趋势是________________。
② 根据上图提供的信息,试推断E氟_______E氧(填“>”“<”或“=”)。
[化学——选修3:物质结构与性质]第ⅢA、ⅤA族元素组成的化合物AlN、AlP、AlAs等是人工合成的半导体材料,它们的晶体结构与单晶硅相似,与NaCl的晶体类型不同。
(1)核电荷数比As小4的原子基态的电子排布式为_________________________。
(2)前四周期元素中,基态原子中未成对电子与其所在周期数相同的元素有______种。
(3)NCl3中心原子杂化方式为________________,NCl3的空间构型为__________。
(4)在AlN晶体中,每个Al原子与________个N原子相连,AlN属于________晶体。
(5)设NaCl的摩尔质量为Mr g·mol-1,食盐晶体的密度为ρ g·cm-3,阿伏加德罗常数的值为NA。食盐晶体中两个距离最近的钠离子中心间的距离为________cm。
【化学——选修3:物质结构基础】近年来,科学家新发现了一些含有碳、氮、硫、铜元素的物质,回答下列问题。
(1)电负性:C_______N(填“>”或“<”)。
(2)图a是某种铜盐配合物的结构,基态铜原子的价电子排布式为_______________,该配合物中铜元素的价态为_______________________。
(3)新的星际分子氰基辛四炔的结构为:H—C≡C—C≡C—C≡C—C≡C—C≡N,氰基辛四炔分子的构型为__________;分子中σ键与π键数目之比为__________________。
(4)C60晶体(图b)中与每个C60紧邻的C60分子有________个;C60易溶于CS2溶剂中,原因是________;设C60晶胞边长为a pm,则C60晶体密度为_____________g·cm-3。
(5)卟吩分子内存在氢键,在图c中用(…)画出氢键结构。
(6)写出图d中表示物质的化学式_________________________,该物质煅烧可冶炼铜,同时产生氧化亚铁,氧化铁和二氧化硫,且生成的氧化亚铁与氧化铁的物质的量之比为2 :1,请写出反应的化学方程式____________________________________________。
【化学——选修3:物质结构与性质】Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的巨大作用。
(1)与N3-含有相同电子数的三原子分子的空间构型是。
(2)Cu具有良好的导电、导热和延展性,请解释Cu具有导电性的原因。
(3)在Cu的催化作用下,乙醇可被空气氧化为乙醛,乙醛分子中碳原子的杂化方式是__________,乙醛分子中H—C—O的键角__________乙醇分子中的H—C—O的键角(填“大于”、“等于”或“小于”)。
(4)Cu+的核外电子排布式为,其在酸性溶液中不稳定,可发生歧化反应生成Cu2+和Cu,但CuO在高温下会分解成Cu2O,试从结构角度解释高温下CuO为何会生成Cu2O。
(5)[Cu(H2O)4]2+为平面正方形结构,其中的两个H2O被Cl-取代有两种不同的结构,试画出[Cu(H2O)2(Cl)2]具有极性的分子的结构式。
(6)Cu3N的晶胞结构如图,N3-的配位数为__________,Cu+半径为a pm,N3-半径为b pm,Cu3N的密度__________g/cm3。(阿伏加德罗为常数用NA表示)
H、C、N、O、Al、Fe是六种常见元素。
(1)Fe位于周期表第周期,第族,其基态原子未成对电子数为_______。碳的同素异形体中,金刚石熔点比C60 _____(填“高”、“低”)。
(2)用“>”或“<”填空:
| 离子半径 |
电负性 |
第一电离能 |
沸点 |
| O2-____Al3+ |
C___N |
N____O |
CH4____ NH3 |
(3)Al能将污水中NO3-转化为N2,同时铝的反应产物还能净化污水,该反应的离子方程式;其中产生的铝的化合物能净水的原理是。
(4)已知①2H2(g) + O2(g) = 2H2O(l) △H=﹣571.66kJ•mol-1
②CH2=CH2(g) + 3O2(g) = 2CO2(g) + 2H2O(l) △H=﹣1306.42kJ•mol-1
写出利用CO2和H2合成(CH2=CH2)的热化学方程式为。
某课题小组合成一种复合材料的基体M的结构简式为: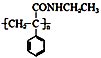
合成路线如下: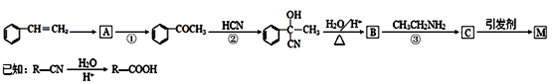
请回答下列问题:
(1)写出A的结构简式____。②的反应类型为____。
(2)B中含有的官能团有。D的名称(系统命名)是。
(3)写出反应⑤的化学方程式____。
(4)写出符合下列条件:①能使FeCl3溶液显紫色;②苯环只有二个取代基;③与新制的Cu(OH)2悬浊液混合加热,有砖红色沉淀生成;④苯环上一氯代物有2种同分异构体。写出有机物B的一种同分异构体的结构简式。
(5)下列说法正确的是。
a.E与分子式相同的醛互为同分异构体
b.F的分子式为C9Hl0NO
c.CH3CH2NH2能与盐酸反应
d.C分子中苯环上取代基含2个 健
健