已知N2(g)+3H2(g) 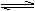 2NH3(g),现向一密闭容器中充入1molN2和3molH2,在高温、高压和催化剂存在条件下发生反应。下列有关说法正确的是
2NH3(g),现向一密闭容器中充入1molN2和3molH2,在高温、高压和催化剂存在条件下发生反应。下列有关说法正确的是
| A.最终可以生成2mol NH3 |
| B.达到化学平衡状态时,正反应和逆反应的速率都为0 |
| C.达到化学平衡状态时,容器中N2、H2和NH3的物质的量之比为1∶3∶2 |
| D.达到化学平衡状态时,N2、H2和NH3的物质的量浓度不再变化 |
下列可以大量共存且溶液是无色的离子组是()
| A.H+、Na+、NO3-、Cu2+ | B.Ba2+、Fe2+、 Cl-、SO42- |
| C.NO3-、SO42-、K+、Mg2+ | D.H+、K+、OH-、NO3- |
配制NaOH溶液时,下列操作情况会使结果偏高的是()
| A.没有洗涤烧杯和玻璃棒 |
| B.移液前,容量瓶中有少量蒸馏水未倒出 |
| C.定容时,俯视容量瓶刻度线观察液面 |
| D.定容后,倒置容量瓶摇匀经平放静置,液面低于刻度线,再加水定容 |
物质的量浓度相同的NaCl、MgCl2、AlCl3三种溶液,当溶液体积比为3:2:1时,三种溶液中Cl—的物质的量之比为()
| A.1:1:1 | B.1:2:3 | C.3:2:1 | D.3:4:3 |
把500ml含有BaCl2和KCl的混合溶液 分成5等份,取一份加入a mol硫酸钠的溶液,恰好使钡离子完全沉淀;另一份加入含有b mol硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为 ()
| A.0.1(b-2a) | B.10(2a-b) | C.10(b-a) | D.10(b-2a) |
粗盐水过滤后仍含有可溶性的CaCl2、MgCl2、Na2SO4等杂质,通过如下几个实验步骤可以除去这些杂质。①加入稍过量的Na2CO3溶液;②加入稍过量的NaOH溶液;③加入稍过量的BaCl2溶液;④滴入稀盐酸至无气泡产生;⑤过滤。正确的操作顺序是( )
| A.③②①⑤④ | B.②③①④⑤ | C.①③②⑤④ | D.③⑤②①④ |