下列说法中错误的是
| A.CO燃烧是放热反应 | B.H2SO4与NaOH反应是放热反应 |
| C.CaO与H2O反应是吸热反应 | D.CaCO3受热分解是吸热反应 |
常温下,将0.1 mol·L-1NaOH溶液与0.06 mol·L-1硫酸溶液等体积混合,该混合溶液的pH等于
| A.1.7 | B.2.0 | C.12.0 | D.12.4 |
下列有关化学用语表示正确的是
A.N2的电子式: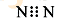 |
B.S2-的结构示意图: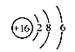 |
C.质子数为53,中子数为78的碘原子: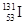 |
| D.CO2的结构简式:O-C-O |
用0.1026mol·L-1的盐酸滴定25.00mL未知浓度的氢氧化钠溶液,滴定达终点时,滴定管中的液面如下图所示,正确的读数为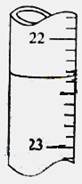
| A.22.30mL | B.22.35mL | C.23.65mL | D.23.70mL |
可逆反应2SO2(g)+O2(g) 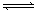 2SO3(g)正在逆向进行时,正反应速率和逆反应速率的大小是
2SO3(g)正在逆向进行时,正反应速率和逆反应速率的大小是
| A. v正>v逆 | B. v正< v逆 | C. v正=v逆 | D.不能确定 |
下列气态氢化物中最不稳定的是
| A.PH3 | B.NH3 | C.H2O | D.H2S |