如图所示晶体结构是一种具有优良的压电、电光等功能的晶体材料的最小结构单元(晶胞)。晶体内与每个“Ti”紧邻的氧原子数和这种晶体材料的化学式分别是(各元素所带电荷均已略去)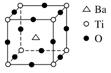
| A.8;BaTi8O12 | B.8;BaTi4O9 | C.6;BaT iO3 iO3 |
D.3;BaTi2O3 |
下列有关现象及对应的离子方程式或化学反应方程式不正确的是:
| A.酸性高锰酸钾可使草酸溶液褪色,其离子方程式为: 2MnO4-+ 5C2O42- + 16H+ = 2Mn2++ 10CO2 ↑+ 8H2O |
| B.S2O32-在酸性环境中不存在,其反应的离子方程式为: S2O32-+ 2H+ = S↓ + SO2↑ + H2O |
C.K2Cr2O7在水中存在平衡:Cr2O72- + H2O  2 CrO42- + 2H+ 2 CrO42- + 2H+可由溶液颜色判断其酸碱性 |
| D.SOCl2是一种液态化合物,遇水有雾及刺激性气味气体产生,其化学反应方程式为: |
SOCl2 + H2O = 2HCl↑ + SO2↑
工业上制备纯硅反应的热化学方程式如下:
SiCl4(g)+2H2(g)="Si(s)+4HCl(g)" ΔH=+QkJ/mol(Q>0)
某温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是:
| A.反应过程中,若增大压强能提高Si(s)的产量 |
| B.若反应开始时SiCl4为1 mol,则达平衡时,吸收热量大于Q kJ |
| C.反应至4 min时,若HCl浓度为0.12 mol/L,则H2的反应速率为0.03 mol/(L·min) |
| D.当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol/L的NaOH溶液恰好中和 |
下图是三种稀酸对Fe – Cr合金随Cr含量变化的腐蚀性实验结果,下列有关说法正确的是:
| A.稀硫酸对Fe – Cr合金的腐蚀性比稀硝酸和稀盐酸的强 |
| B.稀硝酸和铁反应的化学方程式是: Fe + 6HNO3(稀) = Fe(NO3)3 + 3NO2↑+3H2O |
| C.随着Cr含量的增加,稀硝酸对Fe – Cr合金的腐蚀性减弱 |
D.Cr含量大于13%时,因为三种酸中 硫酸的氢离子浓度最大,所以对Fe – Cr合金的腐蚀性最强 硫酸的氢离子浓度最大,所以对Fe – Cr合金的腐蚀性最强 |
低温脱硫技术可用于处理废气中的氮氧化物。发生的化学反应为:
4NH3(g) + 6NO(g)  5N2(g) + 6H2O(g)ΔH<0
5N2(g) + 6H2O(g)ΔH<0
在恒容密闭容器中,下列有关说法正确的是:
| A.平衡时,其他条件不变,降低温度可使该反应的平衡常数减小 |
| B.其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大 |
| C.平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小 |
| D.单位时间内消耗NH3和H2O的物质的量比为2∶3时,反应达到平衡 |
CH3COONa稀溶液中分别加入少量下列物质或改变如下条件,能使比值
c (CH3COO-)/ c (Na+) 一定减小的是:
①固体NaOH②固体KOH③固体NaHSO4④固体CH3COONa⑤冰醋酸⑥降温
| A.只有①③ | B.①③④ |
| C.②④⑤⑥ | D.③④⑥ |