水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O32—+O2+xOH—=Fe3O4+S4O62— +2H2O,下列说法正确的是
| A.x=2 |
| B.参加反应的Fe2+全部做还原剂 |
| C.每生成1mol Fe3O4,反应转移的电子总数为4mol |
| D.1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为1/3mol |
科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图所示),与白磷分子相似。已知断裂1molN—N键吸收193kJ热量,断裂1molN≡N键吸收941kJ热量,则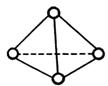
| A.1molN4气体转化为N2时要放出724kJ能量 | B.N4是N2的同位素 |
| C.1molN4气体转化为N2时要吸收217kJ能量 | D.N4是一种新型化合物 |
假定一定量的NH4Cl与Ba(OH)2·8H2O混合物恰好完全反应且它们的总能量为500kJ,那么该反应生成物的总能量一定不可能是
| A.700kJ | B.550kJ | C.450kJ | D.600kJ |
据新华社报道,我国科学家首次合成了镅的一种新同位素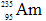 ,它和
,它和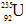 比较,下列叙述中不正确的是()
比较,下列叙述中不正确的是()
| A.具有非常接近的相对原子质量 | B.原子核中的中子数和电子数都不相同 |
C.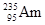 比 比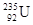 少3个中子 少3个中子 |
D.它们互为同位素 |
已知某+2价离子的电子排布式为1s22s22p63s23p63d9,该元素在周期表中所属的族是
| A.IIA | B.IIB | C.VIII | D.IB |
下列各组指定的元素,不能形成AB2型化合物的是
| A.2s22p2和2s22p4 | B.3s23p4和2s22p4 |
| C.3s2和2s22p5 | D.3s1和3s23p5 |