工业上利用氢气在氯气中燃烧,所得产物再溶于水的方法制得盐酸,流程复杂且造成能量浪费。有人设想利用原电池原理直接制备盐酸的同时,获取电能,假设这种想法可行,下列说法肯定错误的是
| A.两极材料都用石墨,用稀盐酸做电解质溶液 |
| B.通入氢气的电极为原电池的负极 |
| C.电解质溶液中的阴离子向通氯气的电极移动 |
| D.通氯气的电极反应为Cl2+2e—=2Cl— |
含有NaBr、NaI的溶液中通入过量的Cl2,然后将溶液蒸干,并灼烧固体,最后得到的物质是
| A.NaCl | B.NaCl和NaBr | C.NaCl和NaI | D.NaCl和I2 |
用NA表示阿伏加德罗常数,下列说法正确的是
| A.标准状况下,11.2L H2O所含分子数为0.5NA |
| B.标准状况下,足量的Fe与2.24 L Cl2反应转移电子的数目为0.3NA |
| C.1mol·L-1 CaCl2溶液中所含Ca2+离子的数目为NA |
| D.通常状况下,32g O2和O3的混合物所含的氧原子数一定为2NA |
如图在盛有溴水的三支试管中分别加入汽油、四氯化碳和酒精,振荡后静置,出现下列现象,正确的结论是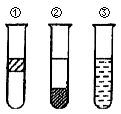
| A.①加入的是CCl4,②加汽油,③加酒精 |
| B.①加入的是汽油,②加CCl4,③加酒精 |
| C.①加入的是汽油,②加酒精,③加CCl4 |
| D.①加入的是酒精,②加CCl4,③加汽油 |
在实验室中,常用KMnO4代替MnO2与浓盐酸反应制取氯气,其反应的化学方程式为
2KMnO4+16HCl(浓)= 2MnCl2+5Cl2↑+2KCl+8H2O,下列叙述中正确的是
| A.反应中KMnO4被氧化 |
| B.氧化产物与还原产物的物质的量之比为2︰5 |
| C.每生成1 mol Cl2时,反应中转移的电子为2 mol |
| D.每消耗16 molHCl时,其中作氧化剂的HCl是10 mol |
下列表示对应化学反应的离子方程式正确的是
| A.铜与硝酸银溶液反应:Cu + Ag+ = Cu2++ Ag |
B.氯气溶于水:Cl2 + H2O H++ Cl-+ HClO H++ Cl-+ HClO |
| C.硫酸溶液中滴加氢氧化钡溶液:H++ SO42-+ Ba2++ OH-= H2O + BaSO4↓ |
| D.氯化钙溶液中通入二氧化碳气体:Ca2++CO2+H2O=CaCO3↓+2H+ |