火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量(相当于25℃、101 kPa下测得的热量)。
(1)该反应的热化学方程式为
(2)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是
. (14分)已知A(g)+B(g) C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
| |温度/ ℃ |
700 |
900 |
830 |
1000 |
1200 |
| 平衡常数 |
1.7 |
1.1 |
1.0 |
0.6 |
0.4 |
回答下列问题:
(1)该反应的平衡常数表达式K=,△H0(填“<”“ >”“ =”);
(2)830℃时,向一个5 L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率v(A)=0.003 mol·L-1·s-1。,则6s时c(A)=mol·L-1, C的物质的量为mol;若反应经一段时间后,达到平衡时A的转化率为,如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率为;
(3)判断该反应是否达到平衡的依据为(填正确选项前的字母):
a.压强不随时间改变 b.气体的密度不随时间改变
c. c(A)不随时问改变 d.单位时间里生成c和D的物质的量相等
(4)1200℃时反应C(g)+D(g) A(g)+B(g)的平衡常数的值为。
A(g)+B(g)的平衡常数的值为。
(14分)一定条件下,二氧化硫和氧气发生反应:
2SO2(g)+ O2 (g)  2SO3(g) △H< 0;
2SO3(g) △H< 0;
(1)降低温度,该反应K值,二氧化硫转化率,化学反应速率
(以上均填增大、减小或不变)
(2)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中 SO2、O2、SO3物质的量变化如右图,反应处于平衡状态的时间是
(3)据图判断,反应进行至20min时,曲线发生变化的原因是(用文字表达)
(4)10min到15min的曲线变化的原因可能是
a.加了催化剂 b.缩小容器体积
c.降低温度 d.增加SO3的物质的量
已知:a、H+(aq) + OH-(aq) = H2O(l) △H=-57.3 kJ•mol-1;
b、1.6gCH4完全燃烧生成水蒸气时放热80.2kJ,1g水蒸气转化成液态水放热2.444kJ。
(1)氢氧化钠与硫酸两稀溶液发生反应,写出表征其中和热的热化学方程式:
(2)写出表征甲烷燃烧热的热化学方程式:
(3)已知2SO2(g)+O2(g)  2SO3(g)反应过程的能量变化如图所示。请回答下列问题:
2SO3(g)反应过程的能量变化如图所示。请回答下列问题: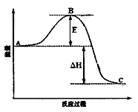
①图中C表示E的大小对该反应的反应热有无影响?。
②该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?,理由是;
(4)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=―24.8 kJ•mol-1
② 3Fe2O3(s)+ CO(g)=2Fe3O4(s)+ CO2(g)△H=―47.2 kJ•mol-1
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H= +640.5 kJ•mol-1
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:
_________________________________________________。
物质的分离和提纯的方法有多种,将适合下列各组物质的分离操作或方法的名称填在相应的横线上。
(1)除去Ca(OH)2溶液中悬浮的 CaCO3;
(2)从碘水中提取碘;
(3)用自来水制取蒸馏水;
(4)分离植物油和水;
(共5分)(1)在小烧杯中加入25 mL蒸馏水,加热至________后,向其中加入5滴___________继续煮沸直至溶液呈__________色,即可制得Fe(OH)3胶体。
(2)已知氢氧化铁胶体是氢氧化铁胶粒吸附多余Fe3+生成的。现将氢氧化铁固体粉碎使粒子直径在10-9~10-7m,并悬浮于水中,再向悬浊液中加入___________或______________,即可制得Fe(OH)3胶体。(填两类不同物质)