下列离子方程式与所述事实相符且正确的是
A.铜溶于稀硝酸:Cu+4H++2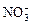 =Cu2++2NO2↑+2H2O =Cu2++2NO2↑+2H2O |
| B.向一定量的FeBr2溶液中滴加少量的氯水Cl2+2Br-=Br2+2Cl- |
C.AlCl3溶液中加入过量的浓氨水:Al3++4NH3·H2O=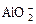 +4 +4 +2H2O +2H2O |
D.用浓盐酸与MnO2反应制取少量氯气:MnO2+4H++2Cl- Mn2++Cl2↑+2H2O Mn2++Cl2↑+2H2O |
可逆反应aA(g) + bB(g) cC(g) + dD(g)符合下图。则下列叙述正确的是( )
cC(g) + dD(g)符合下图。则下列叙述正确的是( )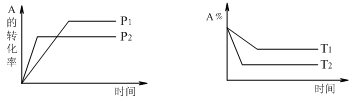
| A.a+b < c+d;正反应吸热 | B.a+b > c+d;正反应放热 |
| C.a+b < c+d;正反应放热 | D.a+b > c+d;正反应吸热 |
可以证明可逆反应N2 + 3H2 2NH3已达到平衡状态的是()
2NH3已达到平衡状态的是()
①一个N≡N断裂的同时,有3个H-H键断裂②一个N≡N键断裂的同时,有6个N-H键断裂③其它条件不变时,混合气体平均相对分子质量不再改变④保持其它条件不变时,体系压强不再改变⑤NH3%、N2%、H2%都不再改变⑥恒温恒容时,密度保持不⑦正反应速率v(H2) = 0.6mol/(L·min),逆反应速率v(NH3) = 0.4mol/(L·min)
| A.全部 | B.只有①③④⑤ | C.②③④⑤⑦ | D.只有③⑤⑥⑦ |
用酚酞作指示剂,以0.100 mol·L-1的NaOH溶液测定装在锥形瓶中的一定体积的盐酸溶液的物质的量浓度。下列操作将导致测定值高于实际值的是( )
| A.标准液在“0”刻度线以上,未予调整就开始滴定 |
| B.碱式滴定管用蒸馏水洗涤后未用标准NaOH溶液润洗 |
| C.观察记录滴定管内液面刻度时滴定前仰视,滴定后俯视 |
| D.酚酞指示剂由无色变为红色时立即停止滴定 |
在给定的四种溶液中,加入以下各种离子,各离子能在原溶液中大量共存的是
| A.滴加石蕊试液显红色的溶液 Fe3+、NH4+、Cl-、SCN- |
| B.pH值为1的溶液 Cu2+、Na+、Mg2+、NO3- |
| C.水电离出来的c(H+)=10-13mol/L的溶液 K+、HCO3-、Br-、Ba2+ |
| D.所含溶质为Na2SO4的溶液 K+、CO32-、NO3-、Al3+ |
常温下,某溶液中由水电离的c(H+) = 1×10-13mol·L-1,该溶液可能是()
①二氧化硫水溶液②氯化铵水溶液③硝酸钠水溶液④氢氧化钠水溶液
| A.①④ | B.①② | C.②③ | D.③④ |