苯甲酸甲酯(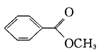 )是一种重要的工业使用的有机溶剂。分析下面的框图关系,然后回答问题:
)是一种重要的工业使用的有机溶剂。分析下面的框图关系,然后回答问题:
已知以下信息:
①有机化合物甲的结构:
②有机化合物乙的结构:
③有机化合物丙的分子式为C7H8O,熔融状态的丙能与钠反应放出氢气,且能够与乙酸发生酯化反应;
④苯在无水AlCl3的作用下与卤代烃、烯烃发生反应,可以在苯环上增加烷基。
(1)乙中含氧官能团的名称 。
(2)甲、乙、丙三种有机物中与苯甲酸甲酯是同分异构体的是 ,在加热条件下能够与新制氢氧化铜悬浊液反应生成砖红色沉淀的是 ,与NaOH溶液加热消耗NaOH最多的是 。
(3)写出C的结构简式: 。
(4)丙生成甲的反应类型与 (选填序号)的反应类型相同。
a.反应I b.反应Ⅱ c.反应Ⅲ d.反应Ⅳ
(5)写出B生成丙的化学方程式: 。
海水中含量最多的四种元素,除了O、H外,另外二种元素的原子半径由大到小的顺序(填元素符号),其中任意三种元素组成的物质中肯定含有的化学键是
键。
空气中含量最多的元素与原子核外电子数最少的元素组成的简单物质的电子式,该分子属于(填“极性”或“非极性”)分子。
在现代生活中,人们越来越注意微量元素的摄入。碘元素对人体健康有着至关重要的作用。为预防碘缺乏病,我国卫生部规定每千克食盐中应含有40~50 mg KIO3。下表是某超市出售的加碘精制盐的有关说明:
| 产品标准 |
GB5461-2000 |
| 配料表 |
氯化钠、碘酸钾、抗结剂 |
| 氯化钠含量 |
≥98.5% |
| 含碘量(以I计) |
20~50 mg/kg |
| 储藏方法 |
密闭、避光、防潮 |
| 食用方法 |
待食品熟后加入 |
| 包装日期 |
见打印批号 |
某同学设计实验验证此食盐中是否含碘和检查该食盐是否为合格产品。
(1)完成下列实验报告:
| 实验步骤 |
实验现象 |
实验结论(步骤2用离子方程式表示) |
| 1.取食盐少许置于一支试管中,加入适量的蒸馏水,振荡 |
固体完全溶解 |
食盐及碘酸钾都能溶于水 |
| 2.向上述溶液滴加适量的亚硫酸氢钠溶液,振荡 |
溶液出现棕黄色 |
|
| 3.再向上述溶液中滴加淀粉溶液,振荡 |
溶液变成蓝色 |
(2)加碘食盐的包装袋上标有食用方法:待食品熟后加入。其原因是
________________________________________________________________________。
(3)该同学取该食盐样品100.0 g完全溶解于水中,然后加入用盐酸酸化的淀粉KI溶液,结果溶液呈蓝色,则反应的离子方程式为
________________________________________________________________________。
为进一步确证样品是否为合格产品,该同学又用0.010 mol·L-1的Na2S2O3溶液滴定,当用去12.00 mL时蓝色刚好褪去(反应方程式为I2+2S2O32-===2I-+S4O62-),通过计算该加碘食盐中KIO3的含量为______mg/kg。由此可判定该食盐为________(填“合格”或“不合格”)产品。
某小组同学设计了如图所示的实验装置。该装置既可用于制取和收集某些气体,又可用于检验气体的性质。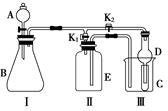
(1)用此装置制取氧气,A、B及E中分别装入的试剂是________________。写出该反应的化学方程式________________________。检查好装置气密性后,先打开K2,关闭K1,反应一段时间后,再关闭K2打开K1,目的是______________________。若A中加入少量NaNO2溶液,B中加硫酸酸化的淀粉KI溶液,C中盛有NaOH浓溶液。打开A的活塞后关闭,再打开K2,并关闭K1,则B中观察到的现象为__________________,C的作用是______________________________________________________。
(2)某同学想用此装置来证明乙醇的结构式,在A中装入无水乙醇,B中装入金属钠,反应中应保证________过量,实验进行时打开K1关闭K2,需要测定的数据是__________________________________________。
(3)若E中不加入任何试剂,此装置还可以用来制取并收集的气体有__________(写出2种)。
已知六种白色粉末分别是KNO3、(NH4)2SO4、Al2O3、MgCl2、Ba(OH)2、无水CuSO4中的一种。除蒸馏水外不得使用任何其他试剂对这些物质进行鉴别,并按要求填写下列空白。
(1)待测物+ ——
——
实验现象:____________________________________________________________________。
被检出物质的化学式:__________________________________________________________。
(2)待测物+ ——
——
实验现象:____________________________________________________________________。
被检出物质的化学式:__________________________________________________________。
(3)待测物+ ——
——
实验现象:___________________________________________________________________。
被检出物质的化学式:________________________________________________________。