某课外兴趣小组探究铝与盐酸反应的反应速率与哪些因素有关。请填写下列空白:
(1)实验化学反应原理: 。
(2)实验用品:试管(普通试管和具支试管各一支)、镊子、乳胶管、玻璃导管、水槽、;稀盐酸(4mol/L)、铝条(片)、水、胶头滴管、温度计。
(3)实验装置(图中铁架台等夹持仪器略去)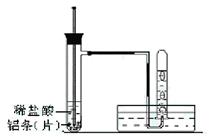
(4)实验方法
①按如图所示连接好实验仪器,检查装置的气密性
②取3块铝条(足量)加入到试管中。
③在盛有铝条的试管中,加入2mL稀盐酸。
④测量试管中溶液的温度。
⑤收集反应产生的氢气。
(5)数据处理及问题讨论
①实验结束后,课外兴趣小组成员将产生氢气的体积与时间作了如下的图。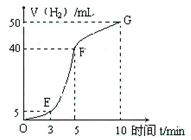
②试判断OE、EF、FG段所收集气体的多少。
OE: ;EF: ;FG: 。
写出这三段时间内产生氢气的速率大小比较(用OE、EF、FG 表示),并解释原因。
速率大小比较: 。原因:________
③如果反应太激烈,为了减缓反应速率而又不减少产生氢气
的量,他在盐酸中分别加入下列溶液:
| A.蒸馏水 | B.NaCl溶液 | C.Na2CO3溶液 | D.CuSO4溶液 E. NaNO3溶液 |
你认为可行的是(填编号) 。
用下面所示的A、B、C三种装置都可制取溴苯.请仔细分析三套装置,然后回答下列问题:
(1)写出三个装置中都发生的反应的化学方程式____________________、____________________;写出B的试管中还发生的反应的化学方程式____________________.
(2)装置A、C中长导管的作用是____________________.
(3)B、C装置已连接好,并进行了气密性检验,也装入了合适的药品,接下来要使反应开始,对B应进行的操作是__________________,对C应进行的操作是____________________.
(4)A中存在加装药品和及时密封的矛盾,因而在实验中易造成的不良后果是____________________.
(5)B中采用了双球吸收管,其作用是________________;反应后双球管中可能出现的现象是________________;双球管内液体不能太多,原因是______________________________________________________.
(6)B装置也存在两个明显的缺点,使实验的效果不好或不能正常进行,这两个缺点是________________、________________.
实验室制取硝基苯常用如图装置。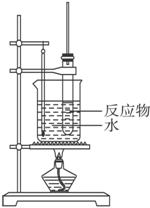
(1)苯的硝化反应是在浓H2SO4和浓HNO3的混合液中进行的,其中浓H2SO4的作用是_____________。
(2)在往试管中加入苯时为何要逐滴加入且不断振荡试管?
(3)温度计悬挂在烧杯中的水中,目的是________________________________。
(4)本实验用水浴加热而不直接用酒精灯加热试管,其优点是_____________。
(5)被水浴加热的试管口都要带一长导管,其作用是_____________。
(6)反应完毕后,如何从试管内混合物中分离出硝基苯?
草酸晶体的组成可用H2C2O4·xH2O表示,为了测定x值,进行如下实验:
称取Wg草酸晶体,配成100.00mL水溶液
(1)称25.00mL所配制的草酸溶液置于锥形瓶内,加入适量稀H2SO4后,用浓度为amol·L-1的KMnO4溶液滴定到KMnO4不再褪色为止,所发生的反应
2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O
试回答:(1)实验中不需要的仪器有(填序号)___________,还缺少的仪器有(填名称)___________________________________________________________________________。
a.托盘天平(带砝码,镊子)b.滴定管 c.100mL量筒 d.100mL容量瓶 e.烧杯
f.漏斗 g.锥形瓶 h.玻璃棒球 i.药匙 j.烧瓶
(2)实验中,标准液KMnO4溶液应装在_____________________式滴定管中,因为______________________________________________________________________。
(3)若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴定至终点,
则所测得的x值会__________________________(偏大、偏小、无影响)
(4)在滴定过程中若用amol·L-1的KMnO4溶液VmL,则所配制的草酸溶液的物质的
量浓度为________________________mol·L-1,由此可计算x的值是____________。
图中的实验装置可用于制取乙炔.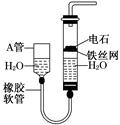
请填空:
(1)图中,A管的作用是___________________________________________________________,
制取乙炔的化学方程式是______________________________________________________.
(2)乙炔通入KMnO4酸性溶液中观察到的现象是______________________________,乙炔发生了________反应.
(3)乙炔通入溴的CCl4溶液中观察到的现象是______________________________,乙炔发生了________反应.
(4)为了安全,点燃乙炔前应______________________,乙炔燃烧时的实验现象是________________________________________________________________________.
某同学设计如图所示的实验装置来粗略测定电石中碳化钙的质量分数。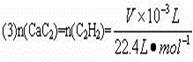
(1)烧瓶中发生反应的化学方程式主要是_________________________________。装置B和C的作用是_______________________________________________。烧瓶要干燥,放入电石后应塞紧橡皮塞,这是为了____________________________________________________。
(2)所用的电石质量不能太大,否则____________;也不能太小,否则____________。若容器B的容积为250 mL,则所用的电石质量应在____________g左右(从以下数据选填:0.30、0.60、1.00、1.50、2.00)(气体体积以标准状况计)。
(3)实验中测得排入量筒中水的体积为V mL(以标准状况计),电石质量为m g,则电石中碳化钙质量分数是____________(不计算导管中残留的水,气体中饱和水蒸气也忽略不计)。