把6molA和5molB两气体通入容积为4L的密闭容器中,一定条件下反应:3A(气)+B(气) 2C(气)+xD(气);△H<0,5min达平衡,此时生成2molC,测得D的平均反应速率为0.1mol·(L·min)-1。下列说法中正确的是
2C(气)+xD(气);△H<0,5min达平衡,此时生成2molC,测得D的平均反应速率为0.1mol·(L·min)-1。下列说法中正确的是
| A.降低平衡体系的温度,逆返应速率变小,正反应速率增大,平衡正向移动 |
| B.恒温下达到平衡的标志是C和D的生成速率相等 |
| C.A的平均反应速率为0.15mol·(L·min)-1 |
| D.B的转化率为25% |
如图所示,当向试管内通入21mL O2时,最后试管中的液面仍在原来的位置,则原试管中NO为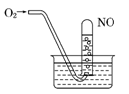
| A.6 mL | B.12 mL | C.16 mL | D.18 mL |
下列离子方程式书写正确的是
| A.将Na投入到CuSO4溶液中:2Na + Cu2+ = 2Na+ + Cu↓ |
| B.向Ba(OH)2溶液中逐滴加入NH4HSO4溶液中加入溶液: Ba2+ + 2OH- +H+ SO42-+ NH4+ = BaSO4↓+ NH3↑+ H2O |
C.向碘化亚铁溶液中通入少量氯气:2Fe2+ +Cl2 = 2Fe3+ +2 Cl- +2 Cl- |
| D.亚硫酸钠溶液中加入硝酸 2H++SO32-= H2O+SO2↑ |
用右图表示的一些物质或概念之间的从属或包含关系中不正确的是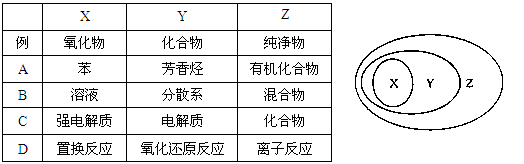
用NA表示阿伏加德罗常数,下列说法中正确的是
①18gD2O含有的电子数为10NA
②同温、同压下,相同体积的氟气和氩气所含的原子数相等
③标准状况下,11.2L以任意比例混合的氮气 和氧气所含的原子数为NA
和氧气所含的原子数为NA
④在标准状况下,22.4LSO3的物质的量为1mol
⑤4℃时5.4mL的水所含的原子总数为0.9NA
⑥0.1molOH-含0.1NA个电子
⑦1mol Na2O2与水完全反应时转移电子数为2NA
| A.③⑤⑥⑦ | B.③⑤ | C.①②④⑦ | D.③④⑤⑥ |
氧可与许多元素形成化合物,下列有关叙述错误的是
A.水分子的结构式为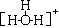 |
| B.氧与氟形成的化合物(OF2)中,氧元素的化合价为-2价 |
C.Na2O2的电子式为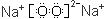 |
D.在MgO晶体中,阴离子的结构示意图可表示为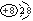 |