在容积相同的A、B两个密闭容器中,分别充入2molSO2和1molO2,使它们在相同温度下发生反应:2SO2+O2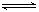 2SO3并达到平衡.在反应过程中,若A容器保持体积不变,B容器保持压强不变,当 A 中的 SO2 的转化率为 25% 时,则 B 容器中 SO2 的转化率应是
2SO3并达到平衡.在反应过程中,若A容器保持体积不变,B容器保持压强不变,当 A 中的 SO2 的转化率为 25% 时,则 B 容器中 SO2 的转化率应是
A.25% B.>25% C.<25% D.12.5%
已知某温度下,Ka (HCN)= 6.2×10-10 mol·L-1、Ka (HF)=" 6.8×10" - 4 mol·L-1、Ka (CH3COOH)= 1.8×10-5 mol·L-1、Ka (HNO2)=" 6.4×10" - 6 mol·L-1。物质的量浓度都为0.1 mol·L-1的下列溶液中,pH最小的是
| A.HCN溶液 | B.HF溶液 | C.CH3COOH溶液 | D.HNO2溶液 |
在容积不变的密闭容器中有反应:X(g) + Y(g) 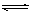 z(g),若Z(g)的物质的量浓度c(Z)与温度T的关系如图所示(曲线上的任意一点都表示平衡状态)。则下列说法不正确的是
z(g),若Z(g)的物质的量浓度c(Z)与温度T的关系如图所示(曲线上的任意一点都表示平衡状态)。则下列说法不正确的是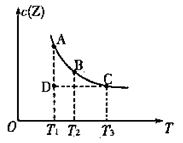
| A.A点与B点相比,B点的c (X)大 |
| B.A点与C点的化学反应速率:前者<后者 |
| C.在反应进行到D点时,V正〉V逆 |
| D.该反应的正反应是吸热反应 |
在铁制品上镀上一定厚度的铜,以下电镀方案中正确的是
| A.铜作阳极,铁制品作阴极,溶液中含Fe2+ |
| B.铜作阴极,铁制品作阳极,溶液中含Cu2+ |
| C.铜作阴极,铁制品作阳极,溶液中含Fe3+ |
| D.铜作阳极,铁制品作阴极,溶液中含Cu2+ |
在0.1mol·L-1 CH3COOH溶液中存在如下电离平衡:CH3COOH CH3COO-+H+,对于该平衡,下列叙述中,正确的是
CH3COO-+H+,对于该平衡,下列叙述中,正确的是
| A.加入水时,平衡向逆反应方向移动 |
| B.加入少量NaOH固体,平衡向正反应方向移动 |
| C.加入少量0.1 mol·L-1 HCl溶液,溶液中[ H+] 减小 |
| D.加入少量CH3COONa固体,平衡向正反应方向移动 |
下列电离方程式的书写中,正确的是
A.NaHS 溶于水::NaHS ==Na+ + HS- HS-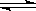 H+ + S2- H+ + S2- |
B.(NH4)2SO4溶于水: (NH4)2SO4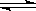 2NH4+ + SO42- 2NH4+ + SO42- |
| C.磷酸溶于水中::H3PO4 ="=" 3H+ + PO43- |
| D.Al(OH)3的电离::Al(OH)3 = Al3+ + 3OH- |