反应4NH3+5O2  4NO+6H2O在5L的密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则下列反应速率正确的是
4NO+6H2O在5L的密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则下列反应速率正确的是
| A.V(O2)=0.01mol·L-1 ·s-1 | B.V(NO)="0.008mol" L-1 ·s-1 |
| C.V(H2O)="0.015mol" L-1 ·s-1 | D.V(NH3)="0.002mol" L-1 ·s-1 |
有反应A2+B2 2AB;在温度和压强可变条件下,产物AB的生成情况如图所示:a为500 ℃,b为300 ℃,从t3开始压缩容器,则下列叙述正确的是
2AB;在温度和压强可变条件下,产物AB的生成情况如图所示:a为500 ℃,b为300 ℃,从t3开始压缩容器,则下列叙述正确的是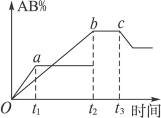
| A.AB为气体,A2、B2中必有一种为非气体;正反应吸热 |
| B.AB为气体,A2、B2中必有一种为非气体;正反应放热 |
| C.AB为固体,A2、B2中必有一种为非气体;正反应放热 |
| D.A2、B2、AB均为气体;正反应吸热 |
下列叙述正确的是
| A.ΔH>0的化学反应一定不能自发进行 |
B.反应2NO2(g) N2O4(l)的熵(体系的混乱度)增大(即ΔS>0) N2O4(l)的熵(体系的混乱度)增大(即ΔS>0) |
| C.混合物中各组分的百分含量改变,化学平衡不一定发生移动 |
| D.混合体系的压强发生改变,化学平衡一定发生移动 |
在密闭容器中进行反应:H2(g) +I2(g) 2HI(g),在温度T1和T2时,产物的量与反应时间的关系如右图所示。符合图示的正确判断是
2HI(g),在温度T1和T2时,产物的量与反应时间的关系如右图所示。符合图示的正确判断是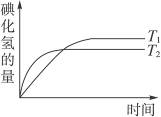
| A.T1>T2,ΔH>0 | B.T1>T2,ΔH<0 |
| C.T1<T2,ΔH>0 | D.T1<T2,ΔH<0 |
下列关于化学反应的熵变的叙述正确的是
| A.化学反应的熵变与反应的方向无关 |
| B.化学反应的熵变直接决定了反应的方向 |
| C.熵值增大的反应都是混乱度增大的反应 |
| D.熵值增大的反应都能自发进行 |
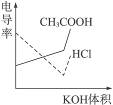
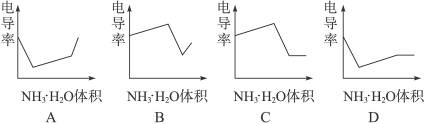
电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变化可以确定滴定反应的终点。右图是KOH溶液分别滴定HCl溶液和CH3COOH溶液的滴定曲线示意图。下列示意图中,能正确表示用NH3·H2O溶液滴定HCl和CH3COOH混合溶液的滴定曲线的是