等体积等浓度的MOH强碱溶液和HA弱酸溶液混和后,混和液中有关离子的浓度应满足的关系是
| A.c(M+)>c( OH―)> c(A-)>c(H+) | B.c(M+)> c(A-)>c(H+)>c( OH―) |
| C.c(M+)> c(A-)>c( OH―)>c(H+) | D.c(M+)>c(H+) ="c(" OH―)+ c(A-) |
25 ℃时,等体积等浓度的NaHCO3和Na2CO3溶液中,下列判断错误的是
| A.均存在电离平衡 |
| B.阴离子数目前者大于后者 |
| C.c(OH-)前者小于后者 |
| D.存在的粒子种类相同 |
海水开发利用的部分过程如图所示。下列说法错误的是
| A.向苦卤中通入Cl2是为了提取溴 |
| B.粗盐可采用除杂和重结晶等过程提纯 |
| C.工业生产中常选用NaOH作为沉淀剂 |
| D.富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收 |
已知0.1 mol•L-1的醋酸溶液中存在电离平衡CH3COOH CH3COO-+H+,要使溶液中c(CH3COOH)/ c(H+) 值减小,可以采取的措施是
CH3COO-+H+,要使溶液中c(CH3COOH)/ c(H+) 值减小,可以采取的措施是
| A.加水 | B.加少量冰醋酸 | C.降低温度 | D.加少量烧碱溶液 |
在由水电离产生的H+浓度为1×10-13mol·L-1的溶液中,一定能大量共存的离子组是
| A.K+、Cl-、NO3-、S2- | B.Na+、Ca2+、Cl-、HCO3- |
| C.K+、Ba2+、Cl-、NO3- | D.SO42-、Mg2+、I-、S2O32- |
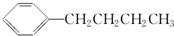 的同分异构体中,含有苯环且苯环上的一氯取代物只有一种的结构共有(不考虑立体异构)
的同分异构体中,含有苯环且苯环上的一氯取代物只有一种的结构共有(不考虑立体异构)
| A.2种 | B.3种 | C.4种 | D.5种 |