可逆反应:2A(g) + 3B(g) 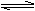 3C(g),一定条件下,在一密闭、恒容的容器中,使一定量A和B气体反应,下列叙述能用来判断达到平衡状态的是
3C(g),一定条件下,在一密闭、恒容的容器中,使一定量A和B气体反应,下列叙述能用来判断达到平衡状态的是
A.各物质的浓度之比为c(A):c(B):c(C) = 2:3:3
B.A、B、C三者共存
C.混合气体的总质量不变
D.单位时间内, 若消耗了 a mol A 物质, 同时也消耗了 1.5 a mol 的C物质
下列热化学方程式或说法正确的是 ()
| A.甲烷的燃烧热为△H=-890kJ·mol-1,则 |
B.500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g) 2NH3(g)△H=-38.6kJ∙mol-1 2NH3(g)△H=-38.6kJ∙mol-1 |
| C.已知:H2(g)+F2(g) = 2HF(g)△H=" —270" kJ/mol,则1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 kJ |
| D.在C中相同条件下,2 mol HF气体的能量小于1 mol氢气与1 mol氟气的能量总和 |
短周期主族元素W、X、Y、Z的原子序数依次增大,W、X原子的最外层电子数之比为4︰3, Z原子比X原子的核外电子数多4。下列说法正确的是 ()
| A.W、Y、Z的氢化物稳定性顺序可能是W>Z>Y |
| B.W、X、Y、Z的原子半径大小顺序Z<Y<X<W |
| C.Z的氧化物对应水化物的酸性一定强于W氧化物对应水化物的酸性 |
| D.Z的某种氧化物可以做新型消毒剂 |
将某200ml MgCl2、K2SO4 、(NH4)2SO4的混合溶液分成两等份,取一份加入含a mol氯化钡溶液,刚好使硫酸根沉淀完全,继续加入含b mol硝酸银溶液,刚好使氯离子沉淀完全,另取一份加入含c mol氢氧化钠的溶液,恰好完全反应,则该溶液中的钾离子
的浓度为()
| A.10(b+2a-c) | B.(2b-c)/0.3 | C.(2b-a+c)/0.3 | D.10(b-c) |
将一定质量的铜粉加入到100mL,某浓度的稀硝酸中充分反应后,容器中剩有m1g铜粉,此时共收集到NO气体336mL(标准状况) 。然后向上述混合物中加入稀硫酸至不再反应为止容器剩有铜粉m2g,则m1-m2为()
| A.5.76 | B.2.88 | C.1.44 | D.4.32 |
已知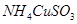 与足量的2mol/L硫酸液混合微热,产生下列现象:①有红色金属生成②产生刺激性气味的气体 ③溶液呈现蓝色。据此判断下列说法正确的是()
与足量的2mol/L硫酸液混合微热,产生下列现象:①有红色金属生成②产生刺激性气味的气体 ③溶液呈现蓝色。据此判断下列说法正确的是()
| A.反应中硫酸作氧化剂 |
B.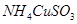 中硫元素被氧化 中硫元素被氧化 |
C.1mol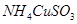 完全反应转移0.5mol电子 完全反应转移0.5mol电子 |
| D.刺激性气味的气体是氨气 |