根据下表部分短周期元素的性质或原子结构,用化学用语回答下列问题。
| 元素编号 |
元素性质或原子结构 |
| R |
元素所处的周期数、主族序数、原子序数均相等 |
| T |
最外层电子数是次外层电子数的2倍 |
| X |
元素最高正价+7价 |
| Y |
第三周期金属元素中原子半径最小 |
| Z |
常温下单质为双原子分子,其氢化物水溶液呈碱性 |
(1)写出元素T的原子结构示意图 ;元素Z单质的电子式 ;写出X在周期表中的位置 ;元素T的最高价氧化物的结构式 .
(2)探寻物质的性质差异是学习的重要方法之一。上述T、X、Y、Z四 种元素最高价氧化物的水化物的酸性最强的是 (填化学式),其中化学性质明显不同于其他三种化合物的
种元素最高价氧化物的水化物的酸性最强的是 (填化学式),其中化学性质明显不同于其他三种化合物的
是 (填化学式),理由是 。
(3)写出R、T、X、三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的一种物质的化学式
(4)由表中元素形成的常见物质A、B、C、D、E可发生以下反应:
A溶液与B溶液(呈碱性)反应的离子方程式为 。
D中含有化学键的类型是 ,属于 (填“离子”或“共价”)化合物。
(9分)有机物A的结构简式为: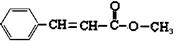
(1)A中含氧官能团为_______________________(写名称);
(2)1mol该化合物与氢气发生加成反应,最多需要_______mol氢气;
(3)A在稀硫酸水溶液中加热水解,得到有机物B和D,D是芳香族化合物,反应的方程式为________________________________________;
(4)A水解生成的芳香族化合物D有多种同分异构体,请写出其中含有苯环、且能发生水解反应和银镜反应的所有同分异构体的结构简式(不包括立体异构)_____。
按要求回答下列问题:
(1)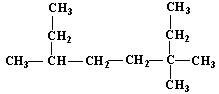 的名称为___________________________;
的名称为___________________________;
(2)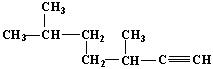 的名称为____________________________;
的名称为____________________________;
(3)2,4-二氯甲苯的结构简式为_________________________ ___;
___;
(4)某物质结构如图所示,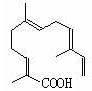
碳原子数为;
该物质可以与下列(填序号)发生反应。
| A.KMnO4酸性溶液 | B.氢气 | C.溴水 | D.NaOH溶液 |
生物质能是一种洁净、可再生的能源。生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一。
(1)上述反应的催化剂含有Cu、Zn、Al等元素。写出基态Al原子的价电子排布图。
(2)根据等电子原理,写出CO分子结构式。
(3)甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀。
①甲醇的沸点比甲醛的高,其主要原因是;甲醛分子中碳原子轨道的杂化类型为。
②甲醛分子的空间构型是;1mol甲醛分子中σ键的数目为。
③在1个Cu2O晶胞中(结构如图所示),所包含的Cu原子数目为。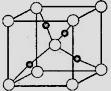
四种元素X、Y、Z、W位于元素周期表的前四周期,已知它们的核电荷数依次增加,且核电荷数之和为51;Y原子的L层p轨道中有2个电子;Z与Y原子的价层电子数相同;W原子的L层电子数与最外层电子数之比为4︰1,其d轨道中的电子数与最外层电子数之比为5︰1。
(1)Y、Z可分别与X形成只含一个中心原子的共价化合物a、b,它们的分子式分别是、;杂化轨道分别是、;a分子的立体结构是。
(2)Y的最高价氧化物和Z的最高价氧化物的晶体类型分别是晶体、晶体。
(3)X的氧化物与Y的氧化物中,分子极性较小的是(填分子式)。
(4)Y与Z比较,电负性较大的,其中W+2价离子的核外电子排布式是。
主族元素W、X、Y、Z的原子序数依次增大,W的原子最外层电子数是次外层电子数的3倍。X、Y和Z分属不同的周期,它们的原子序数之和是W原子序数的5倍。在由元素W、X、Y、Z组成的所有可能的二组分化合物中,由元素W与Y形成的化合物M的熔点最高。请回答下列问题:
(1)W元素原子的L层电子排布式为,W3分子空间构型为;
(2)X单质与水发生主要反应的化学方程式为;
(3)化合物M的化学式为,其晶体结构与NaCl相同,而熔点高于NaCl。M熔点较高的原因是。将一定量的化合物ZX负载在M上可制得ZX/M催化剂,用于催化碳酸二甲酯与月桂醇酯交换合成碳酸二月桂酯。在碳酸二甲酯分子中,碳原子采用的杂化方式有,O—C—O的键角约为;
(4)X、Y、Z可形成立方晶体结构的化合物,其晶胞中X占据所有棱的中心,Y位于顶角,Z处于体心位置,则该晶体的组成为X:Y:Z=;
(5)含有元素Z的盐的焰色反应为色。许多金属盐都可以发生焰色反应,其原因是。