运用元素周期律分析下面推断,其中错误的是
| A.铍(Be)的氧化物的水化物可能具有两性 |
B.砹(At)为有色固体,HAt很不稳定 ,AgAt感光性很强,但不溶于水也不溶于酸 ,AgAt感光性很强,但不溶于水也不溶于酸 |
| C.硫酸锶(SrSO4)是难溶于水的白色固体 |
| D.硒化氢(H2Se)是有色、有毒的气体,比H2S稳定 |
在一固体体积的密闭容器中,保持一定温度,进行以下反应:H2(g)+Br2(g) 2HBr(g)。已知加入 l mol H2和 2mol Br2时,达到平衡后,生成 a molHBr。在相同条件下,起始时加入H2、Br2、HBr的物质的量分别为x、y、z(均不为零),如果仍保持平衡后各组分的物质的量分数不变,则以下推断不正确的是
2HBr(g)。已知加入 l mol H2和 2mol Br2时,达到平衡后,生成 a molHBr。在相同条件下,起始时加入H2、Br2、HBr的物质的量分别为x、y、z(均不为零),如果仍保持平衡后各组分的物质的量分数不变,则以下推断不正确的是
| A.达平衡时HBr物质的量可能仍为a mol |
| B.x、y、z应满足的关系是4x+z=2y |
| C.达平衡时HBr的物质的量为(x+y+z)a/3 |
| D.x、y、z一定满足关系y=2x |
已知下列数据
| 化学键 |
H—H |
Cl—Cl |
H—Cl |
| 生成(拆开)1mol化学键放出(吸收)的能量 |
436kJ |
243kJ |
431kJ |
则下列热化学方程式不正确的是
A. H2(g)+
H2(g)+ Cl2(g)==HCl(g) ;△H=-91.5kJ·mol-1
Cl2(g)==HCl(g) ;△H=-91.5kJ·mol-1
B. H2(g)+
H2(g)+ Cl2(g)==HCl(g) ;△H=+91.5kJ·mol-1
Cl2(g)==HCl(g) ;△H=+91.5kJ·mol-1
C.H2(g)+ Cl2(g)==2HCl(g) ;△H=-183kJ·mol-1
D.2HCl(g) ==H2(g)+ Cl2(g) ;△H=+183kJ·mol-1
某温度下,在2L的密闭容器中,加入1molX(g)和2molY(g)发生反应:X(g)+m Y(g) 3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是
3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是
| A.m=2 | B.两次平衡的平衡常数相同 |
| C.X与Y的平衡转化率之比为1:1 | D.第二次平衡时,Z的浓度为0.4 mol·L-1 |
浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随 的变化如图所示,下列叙述错误的是
的变化如图所示,下列叙述错误的是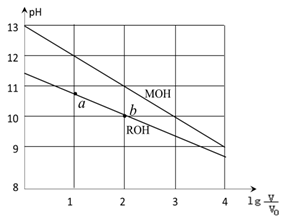
| A.MOH的碱性强于ROH的碱性 |
| B.ROH的电离程度:b点大于a点 |
| C.若两溶液无限稀释,则它们的c(OH-)相等 |
D.当 =2时,若两溶液同时升高温度,则 =2时,若两溶液同时升高温度,则  增大 增大 |
在容积为2.0 L的密闭容器内,物质D在T℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图,下列叙述不正确的是
A.从反应开始到第一次达到平衡时,A物质的平均反应速率为0.667mol/(L·min)
B.该反应的化学方程式为2D(s) 2A(g) + B(g)该反应的平衡常数表达式为K=c(A)2·c(B)
2A(g) + B(g)该反应的平衡常数表达式为K=c(A)2·c(B)
C.已知反应的△H>0,则第5分钟时图像呈现上述变化的原因可能是升高体系的温度
D.若在第7分钟时增加D的物质的量,则表示A的物质的量变化正确的是b曲线