关于氢键,下列说法正确的是
| A.H2S沸点比H2O低原因是水分子间易形成氢键 |
| B.氯化钠易溶于水是因为形成了氢键 |
| C.氨易液化与氨分子间存在氢键无关 |
| D.H2O是一种非常稳定的化合物,这是由于氢键所致 |
关于下列说法中正确的是( )
A.用惰性电极电解熔融氯化钠的离子方程式为:2Cl-+2H2O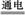 Cl2↑+H2↑+2OH- Cl2↑+H2↑+2OH- |
| B.用惰性电极分别电解CuCl2溶液和MgCl2溶液分别得到单质Cu和Mg |
C.下图为电解足量氯化钠溶液的装置,一段时间后两极收集到气体的体积之比为1∶1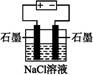 |
| D.电解精炼铜时,相同时间内阴极析出铜的质量比阳极溶解铜的质量大 |
一种太阳能电池的工作原理如图所示,电解质为铁氰化钾K3[Fe(CN)6]和亚铁氰化钾K4[Fe(CN)6]的混合溶液。下列说法中不正确的是( )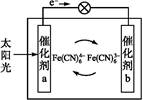
| A.K+移向催化剂b |
B.催化剂a表面发生的化学反应:Fe(CN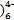 -e- -e- Fe(CN Fe(CN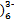 |
C.Fe(CN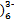 在催化剂b表面被氧化 在催化剂b表面被氧化 |
D.电解质溶液中的Fe(CN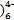 和Fe(CN 和Fe(CN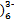 浓度基本保持不变 浓度基本保持不变 |
已知Fe2+与K3[Fe(CN)6]溶液反应呈蓝色。某同学进行如下图的实验,将左铁棒的上、下两端各联上一锌片,而在右铁棒中段联上一铜片(如图1),并将它们同时静置于含有K3[Fe(CN)6]及酚酞的混合胶质溶液中。经一段时间后,发现图中的甲、乙、丙、丁、戊、己等六区均有变化(如图2)。下列关于各区变化情况的判断,正确的是( )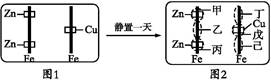
| A.甲区呈现蓝色 | B.乙区呈现红色 |
| C.戊区产生Cu2+离子 | D.丁区产生Fe3+离子 |
下列与装置有关的说法中正确的是( ) 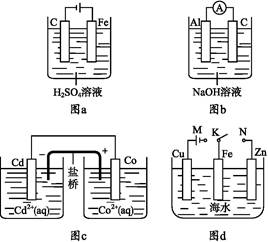
| A.图a中,随着电解的进行溶液中H+的浓度越来越大 |
B.图b中,Al电极作电池的负极,电极反应为Al-3e- Al3+ Al3+ |
C.图c中,发生的反应为Co+Cd2+ Cd+Co2+ Cd+Co2+ |
| D.图d中:K分别与M、N连接,Fe电极均受到保护不会腐蚀 |
现有两个热化学反应方程式: (l)+H2(g)
(l)+H2(g)
 (l) ΔH>0①
(l) ΔH>0① (l)+2H2(g)
(l)+2H2(g)
 (l) ΔH<0②
(l) ΔH<0②
下列说法中不正确的是( )
| A.①②都属于加成反应 |
| B.在通常条件下,①②都能自发进行 |
| C.①吸热、②放热的事实说明苯环中含有的并不是碳碳双键 |
| D.①②中的所有有机物均可使溴水褪色,但褪色原理不完全相同 |